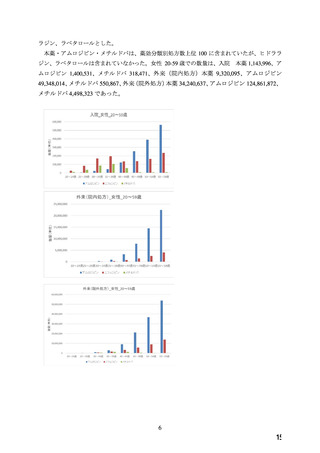
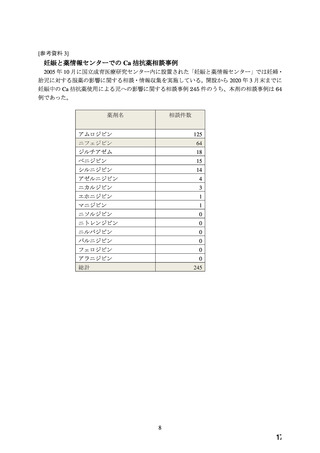
よむ、つかう、まなぶ。
資料1-3 ニフェジピン 調査結果報告書及び添付文書 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29305.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第19回 11/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
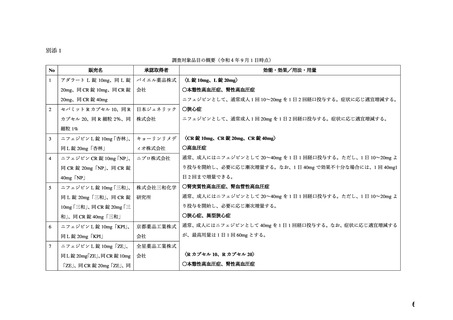
頼に基づく調査及び添付文書改訂の必要性の検討を行った。
なお、機構は、本調査において専門協議を実施しており、本専門協議の専門委員は、調査
対象品目についての専門委員からの申し出等に基づき、
「医薬品医療機器総合機構における
専門協議等の実施に関する達」
(平成 20 年 12 月 25 日付 20 達第 8 号)の規程により、指名
した。
III. WG における検討
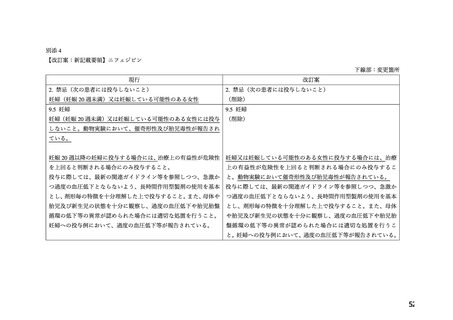
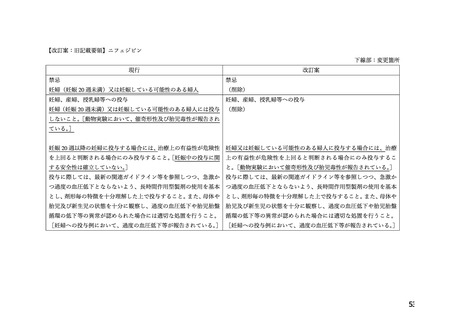
本薬の添付文書における「妊婦(妊娠 20 週未満)又は妊娠している可能性のある婦人」
への注意事項の適切性について、表 1 に示す項目を含む WG 報告書(別添 2)が取りまとめ
られた。
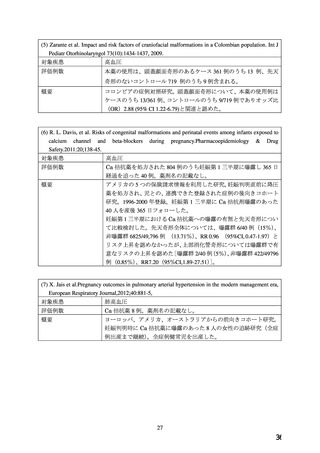
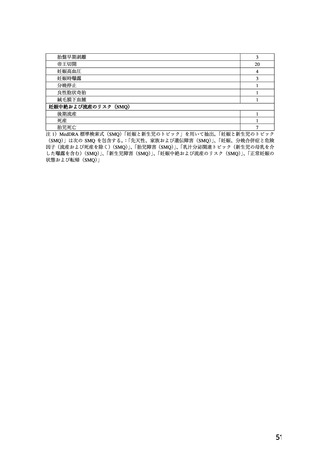
表 1.
WG 報告書の項目
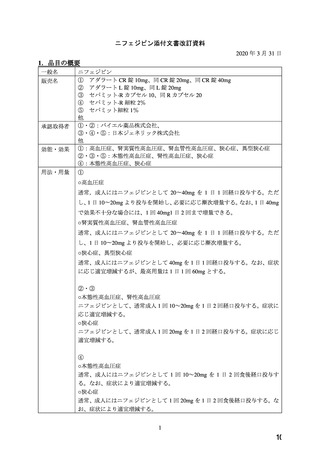
1.品目の概要
5.臨床使用に関する報告
2.背景
6.国内外のガイドライン
3.海外添付文書における記載状況
7.禁忌解除の妥当性
4.動物試験
8.添付文書改訂案
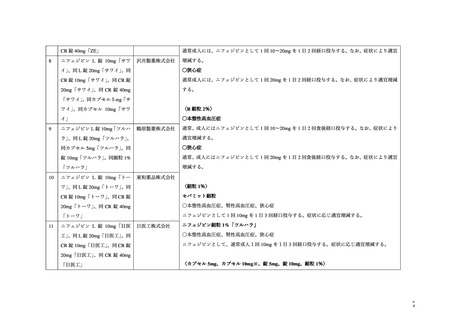
IV. 機構における調査
機構は、WG 報告書を踏まえ、以下の点について検討を行った。
1. 非臨床試験に基づく情報(WG 報告書「4. 動物試験」参照)
1-1.公表文献
WG により、非臨床試験における本薬の催奇形性に関する文献が検索されたが、本薬の先
発医薬品の製造販売承認申請時及び 2011 年の本薬の禁忌事項の見直し時点で評価された知
。
見に加え、新たな知見は認められかった(検索日:2019 年 5 月 14 日)
本薬の先発医薬品の製造販売承認取得者(バイエル薬品株式会社)により、WG 報告書と
同様の検索条件 3を用いて、WG 報告書の検索日以降に公表された非臨床試験における本薬
の催奇形性に関する文献が抽出された(検索日:2022 年 6 月 1 日)
。抽出された 17 報の内
容を確認した結果、本薬の催奇形作用に関する文献はなかった。
2. 臨床使用に基づく情報(WG 報告書「5. 臨床使用に関する報告」参照)
2-1. 公表文献
WG により、Ca 拮抗薬と妊娠に関する文献が抽出された(検索日:2018 年 8 月 7 日)
。抽
出された 10 報及びハンドサーチで特定された 1 報の計 11 報が臨床使用における催奇形性
を検討した公表文献であった(WG 報告書「5. 臨床使用に関する報告」参照)。なお、当該
11 報のうち 3 報は、2011 年の本薬の禁忌事項の見直し時点でも評価された文献であった
。
(WG 報告書文献番号 1、3、4)
3
WG 報告書 p.25 参照
2
2
なお、機構は、本調査において専門協議を実施しており、本専門協議の専門委員は、調査
対象品目についての専門委員からの申し出等に基づき、
「医薬品医療機器総合機構における
専門協議等の実施に関する達」
(平成 20 年 12 月 25 日付 20 達第 8 号)の規程により、指名
した。
III. WG における検討
本薬の添付文書における「妊婦(妊娠 20 週未満)又は妊娠している可能性のある婦人」
への注意事項の適切性について、表 1 に示す項目を含む WG 報告書(別添 2)が取りまとめ
られた。
表 1.
WG 報告書の項目
1.品目の概要
5.臨床使用に関する報告
2.背景
6.国内外のガイドライン
3.海外添付文書における記載状況
7.禁忌解除の妥当性
4.動物試験
8.添付文書改訂案
IV. 機構における調査
機構は、WG 報告書を踏まえ、以下の点について検討を行った。
1. 非臨床試験に基づく情報(WG 報告書「4. 動物試験」参照)
1-1.公表文献
WG により、非臨床試験における本薬の催奇形性に関する文献が検索されたが、本薬の先
発医薬品の製造販売承認申請時及び 2011 年の本薬の禁忌事項の見直し時点で評価された知
。
見に加え、新たな知見は認められかった(検索日:2019 年 5 月 14 日)
本薬の先発医薬品の製造販売承認取得者(バイエル薬品株式会社)により、WG 報告書と
同様の検索条件 3を用いて、WG 報告書の検索日以降に公表された非臨床試験における本薬
の催奇形性に関する文献が抽出された(検索日:2022 年 6 月 1 日)
。抽出された 17 報の内
容を確認した結果、本薬の催奇形作用に関する文献はなかった。
2. 臨床使用に基づく情報(WG 報告書「5. 臨床使用に関する報告」参照)
2-1. 公表文献
WG により、Ca 拮抗薬と妊娠に関する文献が抽出された(検索日:2018 年 8 月 7 日)
。抽
出された 10 報及びハンドサーチで特定された 1 報の計 11 報が臨床使用における催奇形性
を検討した公表文献であった(WG 報告書「5. 臨床使用に関する報告」参照)。なお、当該
11 報のうち 3 報は、2011 年の本薬の禁忌事項の見直し時点でも評価された文献であった
。
(WG 報告書文献番号 1、3、4)
3
WG 報告書 p.25 参照
2
2