よむ、つかう、まなぶ。
再生医療等安全性確保法施行5年後の見直しに係る検討 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_23718.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第72回 2/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
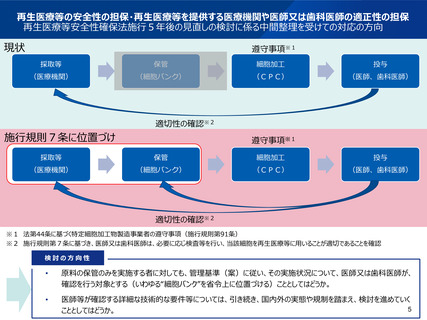
2(4)細胞培養加工施設(CPC)の質の担保
<リスクに応じた構造基準・遵守事項の設定について>
■ 再生医療等安全性確保法施行5年後の見直しの検討に係る中間整理(令和元年12月25日)
現状と課題
•
細胞培養加工施設(CPC)の構造基準や遵守事項は、細胞加工物の種類や、再生医療
等のリスク分類によらず、一律の基準となっている。
議論
•
PRPのみを製造するCPCなど、製造する特定細胞加工物の種類によっては、現行の構造基
準を満たさなくても安全性が確保できる可能性があるため、他の細胞加工物を製造するCPCと
基準を分けることや、CPCとしての届出を不要とすることを検討してもよいのではないかとの意見が
あった。
•
上記について、専門的な見地からの議論が必要ではないかとの意見があった。
今後の対応の方向性
•
PRP等、製造のリスクが比較的低いと考えられる特定細胞加工物のみを製造するCPCについ
て、他の特定細胞加工物を製造するCPCと構造基準を分けることや、CPCの届出を不要と
することが妥当か、リスク分類の議論と併せて、専門的な見地から検討すべきである。
9
<リスクに応じた構造基準・遵守事項の設定について>
■ 再生医療等安全性確保法施行5年後の見直しの検討に係る中間整理(令和元年12月25日)
現状と課題
•
細胞培養加工施設(CPC)の構造基準や遵守事項は、細胞加工物の種類や、再生医療
等のリスク分類によらず、一律の基準となっている。
議論
•
PRPのみを製造するCPCなど、製造する特定細胞加工物の種類によっては、現行の構造基
準を満たさなくても安全性が確保できる可能性があるため、他の細胞加工物を製造するCPCと
基準を分けることや、CPCとしての届出を不要とすることを検討してもよいのではないかとの意見が
あった。
•
上記について、専門的な見地からの議論が必要ではないかとの意見があった。
今後の対応の方向性
•
PRP等、製造のリスクが比較的低いと考えられる特定細胞加工物のみを製造するCPCについ
て、他の特定細胞加工物を製造するCPCと構造基準を分けることや、CPCの届出を不要と
することが妥当か、リスク分類の議論と併せて、専門的な見地から検討すべきである。
9