よむ、つかう、まなぶ。
再生医療等安全性確保法施行5年後の見直しに係る検討 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_23718.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第72回 2/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
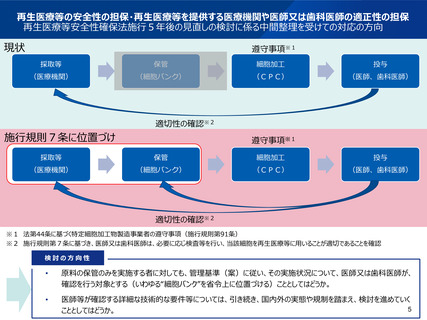
再生医療等の安全性の担保・再生医療等を提供する医療機関や医師又は歯科医師の適正性の担保
再生医療等安全性確保法施行5年後の見直しの検討に係る中間整理を受けての検討状況
検討状況
•
令和元年度、厚生労働科学特別研究を実施。
研究課題名:再生医療等安全性確保法における原料及び細胞加工物の保管に関する管理基準の
策定に資する研究
研究代表者:順天堂大学 革新的医療技術開発センター 准教授 飛田護邦
※ 本研究事業への情報提供のため、令和元年度、細胞バンクの実態調査等業務(受託者:エム・アール・アイ リサーチア
ソシエイツ株式会社)を実施。
•
本研究では、細胞培養加工施設以外において保管(容器の開放、無菌操作は含まれない)された再
生医療等の原料となるヒト由来細胞及び細胞加工物を用いた再生医療等を医師又は歯科医師が行う
際に、医師又は歯科医師が、施行規則第7条に基づく細胞の保管に当たり必要な管理に関して、細胞
培養加工施設以外の原料及び細胞加工物を保管する施設に確認すべき基本となる管理基準(案)
を作成。なお、本管理基準(案)を基に運用を行う際、認定再生医療等委員会の委員が用いるチェッ
クリストの策定、及び学会等による具体的な運用ガイダンスの策定については、引き続き議論することが必
要とされた。
4
再生医療等安全性確保法施行5年後の見直しの検討に係る中間整理を受けての検討状況
検討状況
•
令和元年度、厚生労働科学特別研究を実施。
研究課題名:再生医療等安全性確保法における原料及び細胞加工物の保管に関する管理基準の
策定に資する研究
研究代表者:順天堂大学 革新的医療技術開発センター 准教授 飛田護邦
※ 本研究事業への情報提供のため、令和元年度、細胞バンクの実態調査等業務(受託者:エム・アール・アイ リサーチア
ソシエイツ株式会社)を実施。
•
本研究では、細胞培養加工施設以外において保管(容器の開放、無菌操作は含まれない)された再
生医療等の原料となるヒト由来細胞及び細胞加工物を用いた再生医療等を医師又は歯科医師が行う
際に、医師又は歯科医師が、施行規則第7条に基づく細胞の保管に当たり必要な管理に関して、細胞
培養加工施設以外の原料及び細胞加工物を保管する施設に確認すべき基本となる管理基準(案)
を作成。なお、本管理基準(案)を基に運用を行う際、認定再生医療等委員会の委員が用いるチェッ
クリストの策定、及び学会等による具体的な運用ガイダンスの策定については、引き続き議論することが必
要とされた。
4