よむ、つかう、まなぶ。
厚生労働大臣の定める先進医療及び施設基準の制定等に伴う手続き等の取扱いについて (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27055.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第79回 7/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
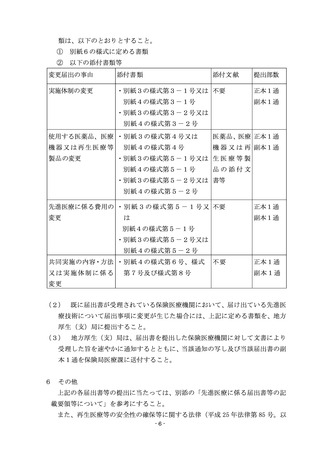
保険医療機関が実施する先進医療の施設基準において、実績報告が定めら
れている場合は、当該基準に従い、別紙7の様式第1号及び第2号(様式第
2号を用いて報告する症例については、第3の2(1)の安全性報告におい
て報告がなされたものを除く。)を用いて、当該保険医療機関の所在地を管
轄する地方厚生(支)局に報告すること。報告を受けた地方厚生(支)局は
速やかに保険局医療課に報告すること。
②
先進医療B
先進医療会議等において承認された試験期間中に実績報告を求められた
技術については、求められた試験期間又は症例数に達した場合、速やかに医
政局研究開発振興課に報告すること。
(3)
総括報告
申請医療機関は先進医療会議において承認された試験期間若しくは症例登録
が終了した場合又は試験期間若しくは症例登録が終了していない場合でも試験
を終了する場合には、別紙7の様式第1号(再生医療等安全性確保法又は臨床
研究法が適用される研究を実施する場合にあっては、主要評価項目報告書又は
総括報告書の概要を添付すること。)(※)を医政局研究開発振興課に速やか
に報告すること。
平成 24 年9月 30 日時点で、先進医療Bとして実施している研究であって、
再生医療等安全性確保法及び臨床研究法のいずれも適用されないものについて
は、この限りではないが、可能な限り報告することが望ましい。
※
再生医療等安全性確保法が適用される研究にあっては、認定再生医療等
委員会で「適」とされた主要評価項目報告書又は総括報告書及びその概要を
医政局研究開発振興課に提出すること。
臨床研究法に規定する臨床研究にあっては、認定臨床研究審査委員会で
「承認」とされた主要評価項目報告書又は総括報告書及びその概要を医政
局研究開発振興課に提出すること。
2
安全性報告等
(1)
安全性報告
先進医療の実施に伴う重篤な有害事象及び不具合(以下「重篤な有害事象等」
という。)により、次に掲げる症例(①又は②に掲げる症例に該当の適否の判
断に迷う場合を含む。)が発生したものについては、それぞれ①又は②に掲げ
る期日までに別紙7の様式第2号に定める書類を、先進医療Aについては地方
厚生(支)局に報告すること。報告を受けた地方厚生(支)局は速やかに保険
局医療課に報告すること。先進医療Bについては、医政局研究開発振興課に報
- 15 -
れている場合は、当該基準に従い、別紙7の様式第1号及び第2号(様式第
2号を用いて報告する症例については、第3の2(1)の安全性報告におい
て報告がなされたものを除く。)を用いて、当該保険医療機関の所在地を管
轄する地方厚生(支)局に報告すること。報告を受けた地方厚生(支)局は
速やかに保険局医療課に報告すること。
②
先進医療B
先進医療会議等において承認された試験期間中に実績報告を求められた
技術については、求められた試験期間又は症例数に達した場合、速やかに医
政局研究開発振興課に報告すること。
(3)
総括報告
申請医療機関は先進医療会議において承認された試験期間若しくは症例登録
が終了した場合又は試験期間若しくは症例登録が終了していない場合でも試験
を終了する場合には、別紙7の様式第1号(再生医療等安全性確保法又は臨床
研究法が適用される研究を実施する場合にあっては、主要評価項目報告書又は
総括報告書の概要を添付すること。)(※)を医政局研究開発振興課に速やか
に報告すること。
平成 24 年9月 30 日時点で、先進医療Bとして実施している研究であって、
再生医療等安全性確保法及び臨床研究法のいずれも適用されないものについて
は、この限りではないが、可能な限り報告することが望ましい。
※
再生医療等安全性確保法が適用される研究にあっては、認定再生医療等
委員会で「適」とされた主要評価項目報告書又は総括報告書及びその概要を
医政局研究開発振興課に提出すること。
臨床研究法に規定する臨床研究にあっては、認定臨床研究審査委員会で
「承認」とされた主要評価項目報告書又は総括報告書及びその概要を医政
局研究開発振興課に提出すること。
2
安全性報告等
(1)
安全性報告
先進医療の実施に伴う重篤な有害事象及び不具合(以下「重篤な有害事象等」
という。)により、次に掲げる症例(①又は②に掲げる症例に該当の適否の判
断に迷う場合を含む。)が発生したものについては、それぞれ①又は②に掲げ
る期日までに別紙7の様式第2号に定める書類を、先進医療Aについては地方
厚生(支)局に報告すること。報告を受けた地方厚生(支)局は速やかに保険
局医療課に報告すること。先進医療Bについては、医政局研究開発振興課に報
- 15 -