よむ、つかう、まなぶ。
厚生労働大臣の定める先進医療及び施設基準の制定等に伴う手続き等の取扱いについて (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27055.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第79回 7/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
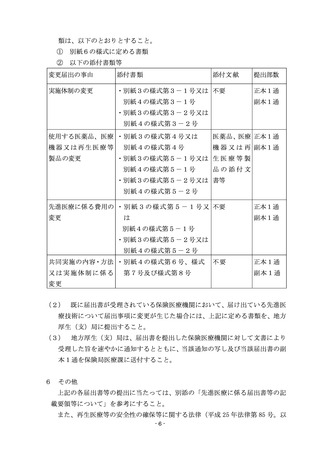
下「再生医療等安全性確保法」という。)又は臨床研究法(平成 29 年法律第 16
号)が適用される研究を先進医療Aとして実施するに当たっては、先進医療告示
第3各号に掲げる先進医療(以下「先進医療B」という。)に係る記載のうち、
再生医療等安全性確保法又は臨床研究法が適用される研究に係る記載も参照す
ること。
第2
先進医療Bについて
1
新規技術に係る手続
(1)
先進医療実施届出書の提出
新規技術について、先進医療Bとして保険診療との併用を希望する保険医療
機関(以下「申請医療機関」という。)の開設者が提出する先進医療実施届出
書及び添付書類等は以下のとおりとし、医政局研究開発振興課に提出すること。
なお、再生医療等安全性確保法が適用される研究を実施する場合にあっては、
先進医療実施届出書の実施責任医師は、同法に規定する実施責任者と同一の者
とすること。また、臨床研究法に規定する臨床研究を実施する場合にあっては、
先進医療実施届出書の実施責任医師は同法に規定する研究責任医師と同一の者
とし、同法に基づく多施設共同研究を実施する場合にあっては、申請医療機関
の実施責任医師(研究責任医師)は同法に規定する研究代表医師と同一の者と
すること。
①
別紙1の様式第1-1号に定める先進医療実施届出書(厚生労働大臣あて。
正本1通及び副本7通(添付書類を含む。))
ただし、多施設共同研究を行う場合、申請医療機関の開設者は、協力医療
機関分もとりまとめの上、提出すること。
②
別紙1の様式第2号から様式第 10 号までに定める書類及び以下に定める
添付書類
ア
文献情報に記載した全ての原文及び和訳概要
イ
試験実施計画書(※1及び※2を含む。)
ウ
再生医療等安全性確保法第4条第1項に規定する再生医療等提供計画並
びに再生医療等の安全性の確保等に関する法律施行規則(平成 26 年厚生労
働省令第 110 号。以下「再生医療等安全性確保法施行規則」という。)第
8条の8第1項に規定する利益相反管理基準及び同条第3項に規定する利
益相反管理計画(再生医療等安全性確保法が適用される研究の場合に限る。)
(※3)
エ
臨床研究法第5条第1項に規定する実施計画並びに臨床研究法施行規則
(平成 30 年厚生労働省令第 17 号)第 21 条第1項に規定する利益相反管理
-7-
号)が適用される研究を先進医療Aとして実施するに当たっては、先進医療告示
第3各号に掲げる先進医療(以下「先進医療B」という。)に係る記載のうち、
再生医療等安全性確保法又は臨床研究法が適用される研究に係る記載も参照す
ること。
第2
先進医療Bについて
1
新規技術に係る手続
(1)
先進医療実施届出書の提出
新規技術について、先進医療Bとして保険診療との併用を希望する保険医療
機関(以下「申請医療機関」という。)の開設者が提出する先進医療実施届出
書及び添付書類等は以下のとおりとし、医政局研究開発振興課に提出すること。
なお、再生医療等安全性確保法が適用される研究を実施する場合にあっては、
先進医療実施届出書の実施責任医師は、同法に規定する実施責任者と同一の者
とすること。また、臨床研究法に規定する臨床研究を実施する場合にあっては、
先進医療実施届出書の実施責任医師は同法に規定する研究責任医師と同一の者
とし、同法に基づく多施設共同研究を実施する場合にあっては、申請医療機関
の実施責任医師(研究責任医師)は同法に規定する研究代表医師と同一の者と
すること。
①
別紙1の様式第1-1号に定める先進医療実施届出書(厚生労働大臣あて。
正本1通及び副本7通(添付書類を含む。))
ただし、多施設共同研究を行う場合、申請医療機関の開設者は、協力医療
機関分もとりまとめの上、提出すること。
②
別紙1の様式第2号から様式第 10 号までに定める書類及び以下に定める
添付書類
ア
文献情報に記載した全ての原文及び和訳概要
イ
試験実施計画書(※1及び※2を含む。)
ウ
再生医療等安全性確保法第4条第1項に規定する再生医療等提供計画並
びに再生医療等の安全性の確保等に関する法律施行規則(平成 26 年厚生労
働省令第 110 号。以下「再生医療等安全性確保法施行規則」という。)第
8条の8第1項に規定する利益相反管理基準及び同条第3項に規定する利
益相反管理計画(再生医療等安全性確保法が適用される研究の場合に限る。)
(※3)
エ
臨床研究法第5条第1項に規定する実施計画並びに臨床研究法施行規則
(平成 30 年厚生労働省令第 17 号)第 21 条第1項に規定する利益相反管理
-7-