よむ、つかう、まなぶ。
【資料5-1】医薬品等行政評価・監視委員会における海外調査の状況 (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26381.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第8回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
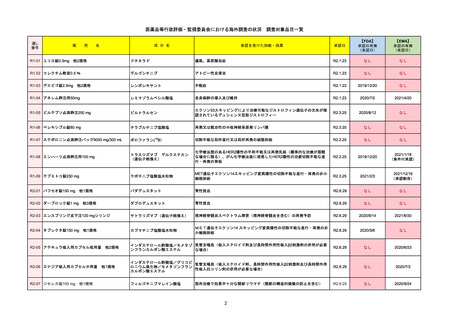
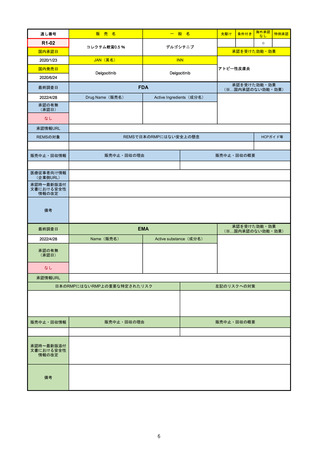
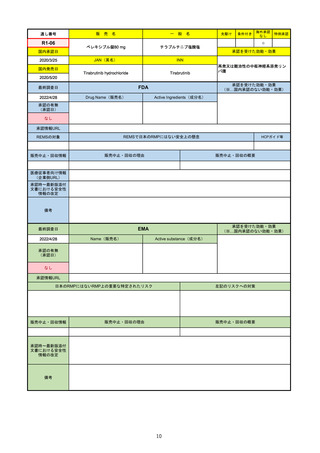
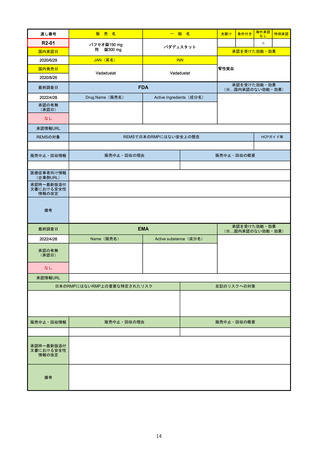
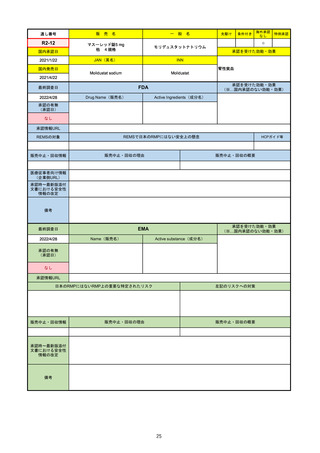
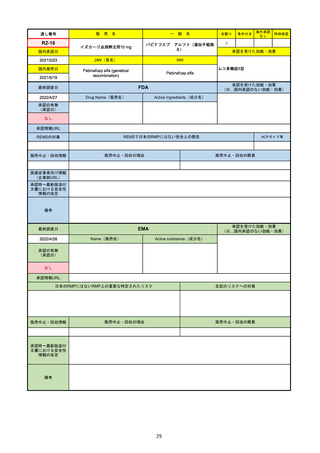
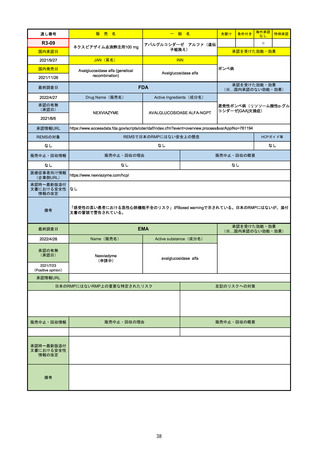
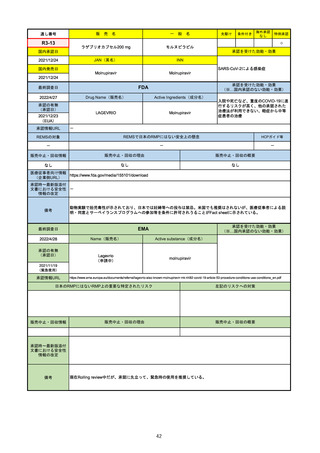
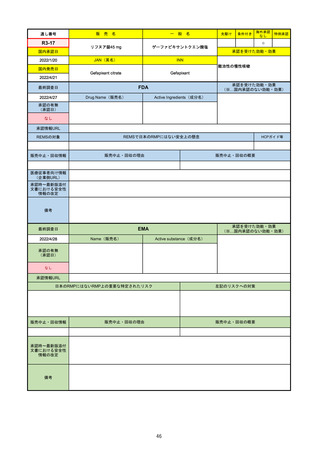
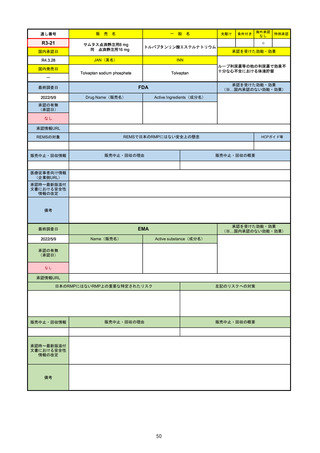
販
通し番号
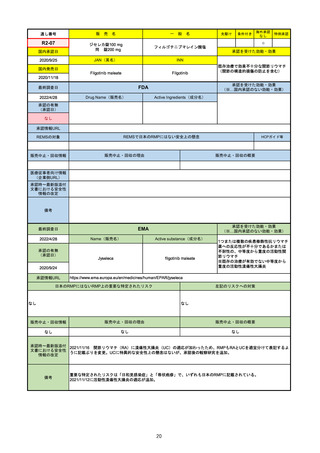
R2-14
売
名
一
国内承認日
国内発売日
名
コロナウイルス修飾ウリジンRNAワクチ
ン(SARS-CoV-2)
(有効成分名:トジナメラン)
コミナティ筋注
2021/2/14
般
JAN(英名)
INN
Tozinameran
Tozinameran
先駆け
条件付き
海外承認
なし
特例承認
0
0
0
○
承認を受けた効能・効果
SARS-CoV-2による感染症の予防
2021/2/16
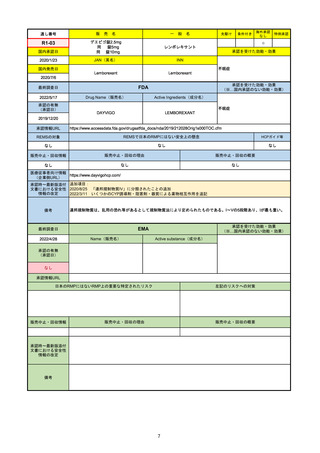
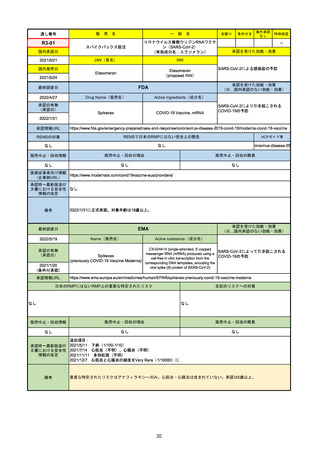
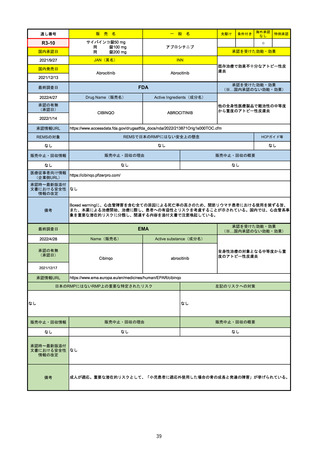
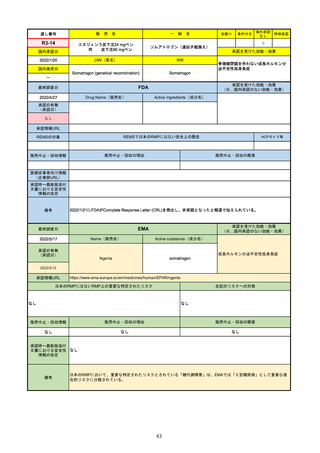
承認を受けた効能・効果
(※…国内承認のない効能・効果)
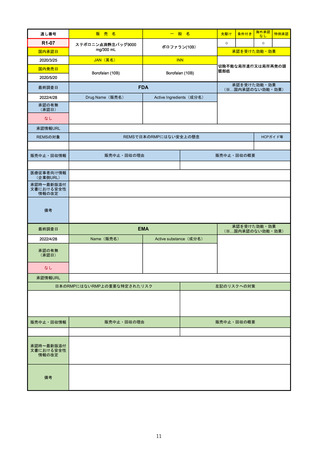
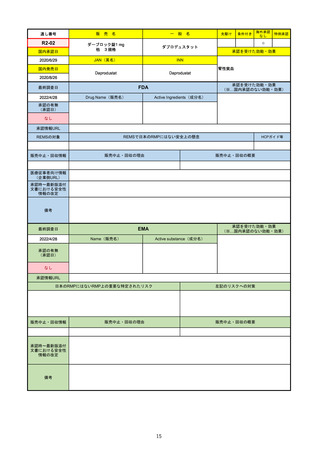
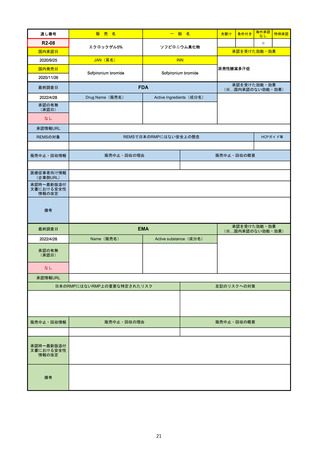
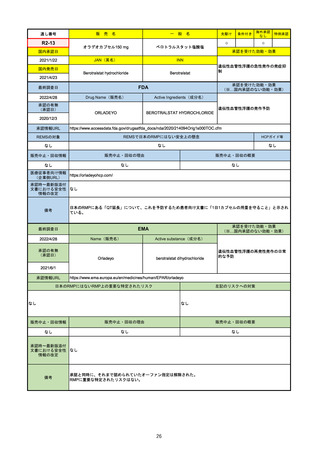
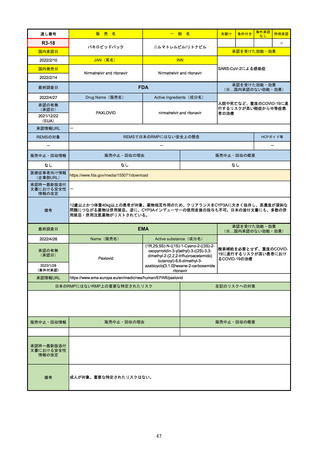
FDA
最終調査日
Drug Name(販売名)
2022/4/27
承認の有無
(承認日)
Active Ingredients(成分名)
Comirnaty
COVID-19 Vaccine, mRNA
SARS-CoV-2により引き起こされる
COVID-19の予防
2021/8/23
承認情報URL
https://www.fda.gov/vaccines-blood-biologics/comirnaty
REMSで日本のRMPにはない安全上の懸念
REMSの対象
HCPガイド等
https://www.fda.gov/emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/comirna
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
http://labeling.pfizer.com/ShowLabeling.aspx?id=14471
(企業側URL)
承認時~最新版添付
文書における安全性 なし
情報の改定
2021/8/23の販売承認は16歳以上を対象としており、5~15歳については引き続き緊急使用許可(EUA)で対応。12~15歳
は16歳以上と同様の投与が可能だが、5~11歳はキャップの色がオレンジ色で区別されており、濃度や用量が異なることが
Fact sheetに記載されている。
備考
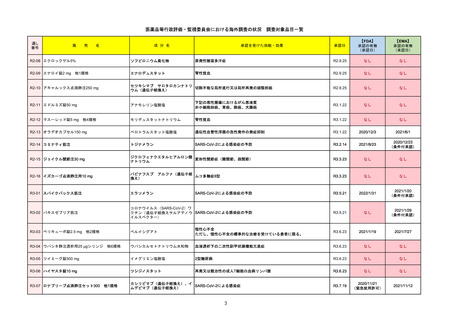
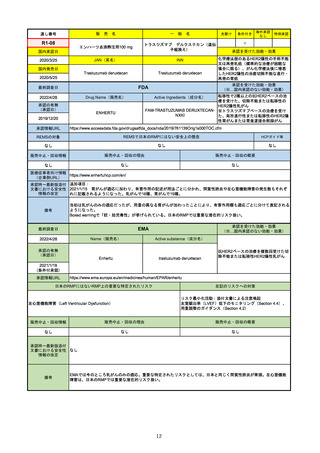
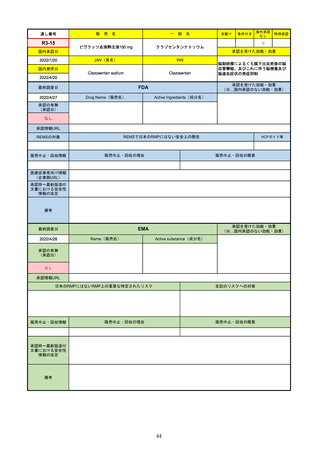
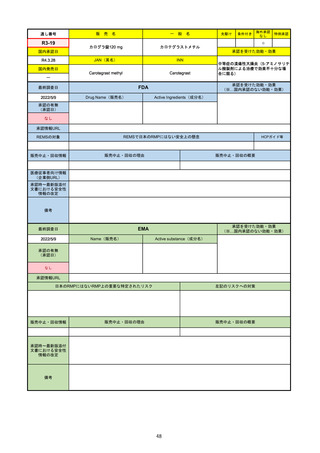
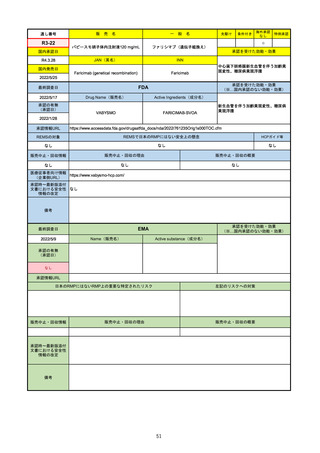
2022/5/19
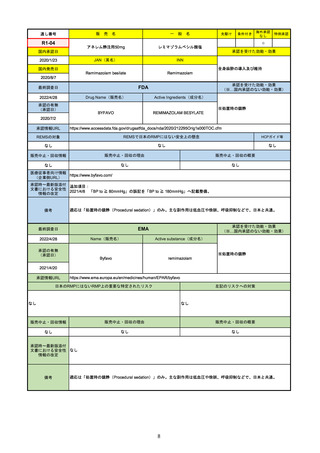
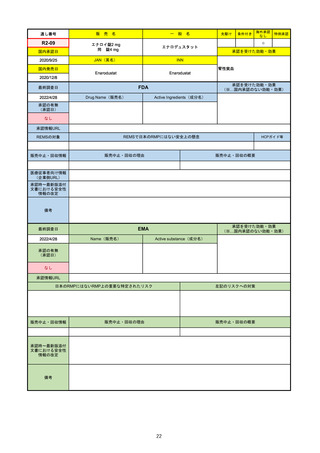
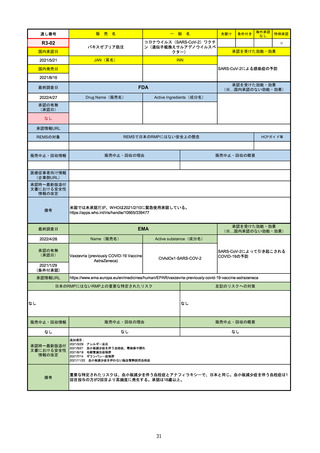
承認の有無
(承認日)
Name(販売名)
Active substance(成分名)
Single-stranded, 5’-capped messenger
RNA produced using a cell-free in vitro SARS-CoV-2によって引き起こされる
COVID-19の予防
transcription from the corresponding
DNA templates, encoding the viral spike
(S) protein of SARS-CoV-2
Comirnaty
2020/12/23
(条件付承認)
承認情報URL
承認を受けた効能・効果
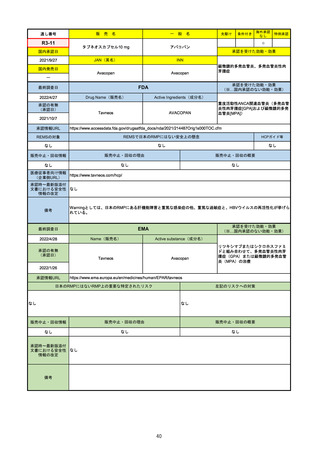
(※…国内承認のない効能・効果)
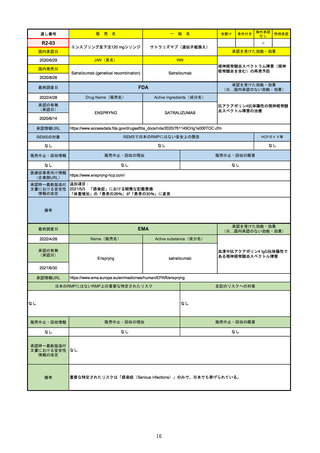
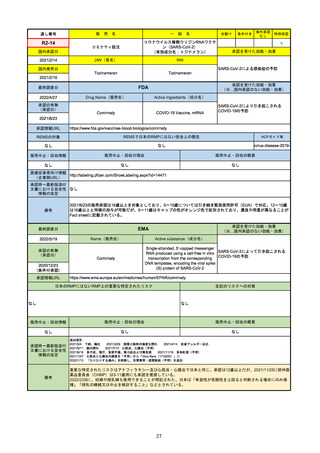
EMA
最終調査日
https://www.ema.europa.eu/en/medicines/human/EPAR/comirnaty
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付
文書における安全性
情報の改定
備考
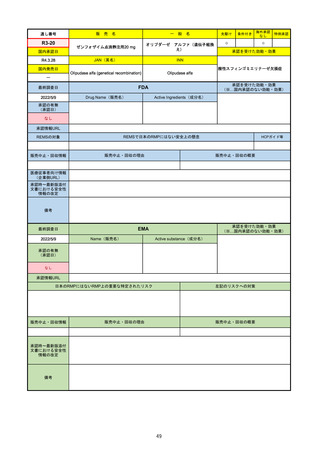
追加項目:
2021/3/4 下痢、嘔吐
2021/3/29 接種上腕部の極度な腫れ
2021/4/14 皮膚アレルギー反応
2021/5/11 顔の腫れ
2021/7/14 心筋炎、心膜炎(不明)
2021/9/16 多汗症、寝汗、食欲不振、無力症および倦怠感
2021/11/18 多形紅斑(不明)
2021/12/7 心筋炎と心膜炎の頻度を「不明」から「Very Rare(1/10000)」に
2022/1/13 「ひりひりする痛み」を削除し、知覚異常・感覚鈍麻(不明)を追加
重要な特定されたリスクはアナフィラキシー及び心筋炎・心膜炎で日本と同じ。承認は12歳以上だが、2021/11/25に欧州医
薬品委員会(CHMP)は5-11歳用にも承認を推奨している。
2022/2/28に、妊婦や授乳婦も使用できることが明記された。日本は「有益性が危険性を上回ると判断される場合にのみ接
種」「授乳の継続又は中止を検討すること」などとされている。
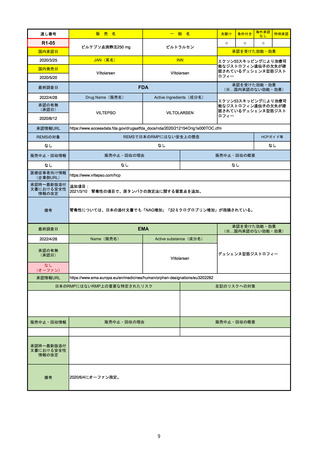
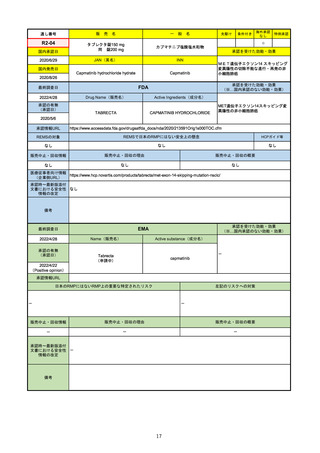
27
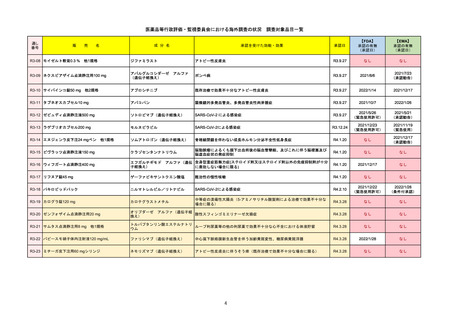
通し番号
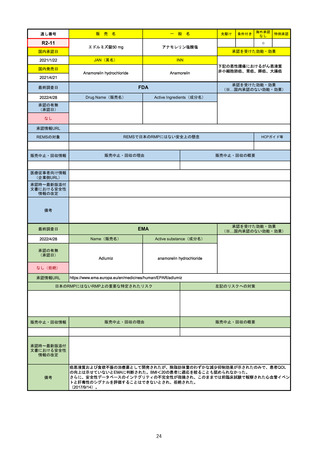
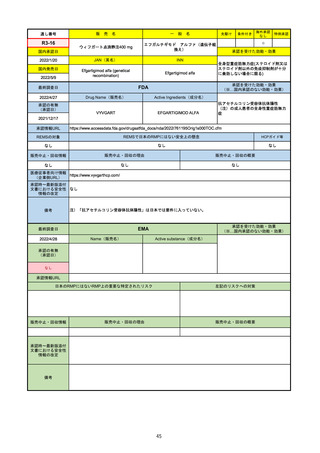
R2-14
売
名
一
国内承認日
国内発売日
名
コロナウイルス修飾ウリジンRNAワクチ
ン(SARS-CoV-2)
(有効成分名:トジナメラン)
コミナティ筋注
2021/2/14
般
JAN(英名)
INN
Tozinameran
Tozinameran
先駆け
条件付き
海外承認
なし
特例承認
0
0
0
○
承認を受けた効能・効果
SARS-CoV-2による感染症の予防
2021/2/16
承認を受けた効能・効果
(※…国内承認のない効能・効果)
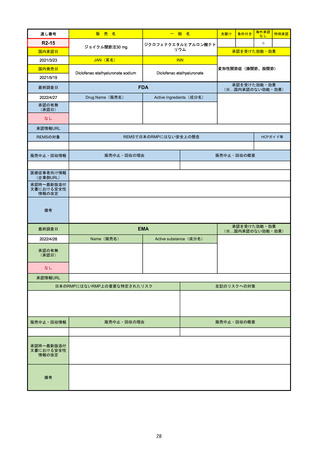
FDA
最終調査日
Drug Name(販売名)
2022/4/27
承認の有無
(承認日)
Active Ingredients(成分名)
Comirnaty
COVID-19 Vaccine, mRNA
SARS-CoV-2により引き起こされる
COVID-19の予防
2021/8/23
承認情報URL
https://www.fda.gov/vaccines-blood-biologics/comirnaty
REMSで日本のRMPにはない安全上の懸念
REMSの対象
HCPガイド等
https://www.fda.gov/emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/comirna
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
http://labeling.pfizer.com/ShowLabeling.aspx?id=14471
(企業側URL)
承認時~最新版添付
文書における安全性 なし
情報の改定
2021/8/23の販売承認は16歳以上を対象としており、5~15歳については引き続き緊急使用許可(EUA)で対応。12~15歳
は16歳以上と同様の投与が可能だが、5~11歳はキャップの色がオレンジ色で区別されており、濃度や用量が異なることが
Fact sheetに記載されている。
備考
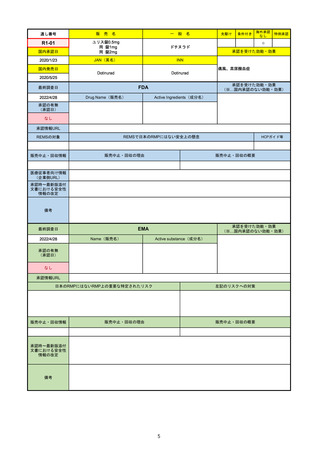
2022/5/19
承認の有無
(承認日)
Name(販売名)
Active substance(成分名)
Single-stranded, 5’-capped messenger
RNA produced using a cell-free in vitro SARS-CoV-2によって引き起こされる
COVID-19の予防
transcription from the corresponding
DNA templates, encoding the viral spike
(S) protein of SARS-CoV-2
Comirnaty
2020/12/23
(条件付承認)
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
EMA
最終調査日
https://www.ema.europa.eu/en/medicines/human/EPAR/comirnaty
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付
文書における安全性
情報の改定
備考
追加項目:
2021/3/4 下痢、嘔吐
2021/3/29 接種上腕部の極度な腫れ
2021/4/14 皮膚アレルギー反応
2021/5/11 顔の腫れ
2021/7/14 心筋炎、心膜炎(不明)
2021/9/16 多汗症、寝汗、食欲不振、無力症および倦怠感
2021/11/18 多形紅斑(不明)
2021/12/7 心筋炎と心膜炎の頻度を「不明」から「Very Rare(1/10000)」に
2022/1/13 「ひりひりする痛み」を削除し、知覚異常・感覚鈍麻(不明)を追加
重要な特定されたリスクはアナフィラキシー及び心筋炎・心膜炎で日本と同じ。承認は12歳以上だが、2021/11/25に欧州医
薬品委員会(CHMP)は5-11歳用にも承認を推奨している。
2022/2/28に、妊婦や授乳婦も使用できることが明記された。日本は「有益性が危険性を上回ると判断される場合にのみ接
種」「授乳の継続又は中止を検討すること」などとされている。
27