よむ、つかう、まなぶ。
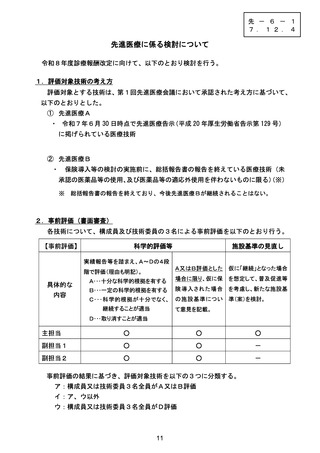
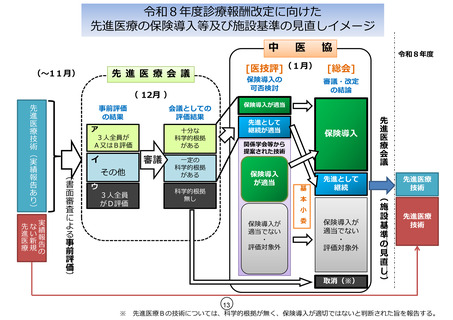
技-2-2 先進医療の医技評報告 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_68611.html |
| 出典情報 | 中央社会保険医療協議会 診療報酬調査専門組織・医療技術評価分科会(令和7年度第2回 1/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1) 対象
・過去に1回以上の流産歴があり、今回妊娠で臨床的に流産と診断された患者。子宮内に 流産胎
児、絨毛が残存している場合、または、体外に排出されたが流産胎児・絨毛を回収できた場合。
・今回妊娠で臨床的に死産と診断された患者。子宮内に死産胎児、絨毛が残存している場合、また
は、体外に排出されたが死産胎児・絨毛を回収できた場合。
2) 胎児(胎芽)・絨毛の採取
採取方法は下記の a)あるいは b)の手順にて行う。
a) 流死産物が体内に存在する場合
体内にある流死産物(胎児(胎芽)・絨毛)を子宮内容除去術(流産手術)、分娩誘発術または帝王
切開術により採取し、絨毛組織または胎児組織・胎児成分のみを分離する。
b) 流死産物が体外に排出された場合
体外へ排出された流死産物(胎児(胎芽)・絨毛)の組織から、絨毛組織・胎児成分のみを分離す
る。
24
流死産検体を用いた遺
伝子検査
自然流産(自然流産の既
往歴を有するもの)又は 分離した絨毛・胎児組織の一部を解析施設に移送し、NGS法にて解析する。
死産
3) 検査・解析
分離した絨毛・胎児組織の一部を解析施設であるタカラバイオ株式会社の衛生検査所に 移送し、
核酸抽出を行う。抽出核酸から Embgenix TM PGT-A Kit を用いて全ゲノム増幅、DNAライブラリー
の調製後、次世代シーケンサー(MiSeq System)を用いて塩基配列を決定する。得られた塩基配列
データから Embgenix TM Analysis Software を用いて染色体の数的異常、不均衡型構造異常を検
出する。
尚、分離した絨毛・胎児組織の一部を染色体G-banding法にも提出し、結果を比較する。
令4.12.1
4) 検査結果の判定と報告
(1)常染色体、性染色体のコピー数に有意の増加、減少が検出されないものを染色体正常核型と判
定する。
(2)解析結果を研究実施施設にて患者に説明する。染色体構造異常(転座など)が判明した場合は、
患者及びそのパートナーの染色体検査(G-banding法)を予定するが、その際には遺伝専門医など
による遺伝カウンセリングを実施する。
【選択基準】
・対象:本研究の対象者は、
1) 1回以上顕微授精を実施しても移植可能胚が得られず、または胚移植しても妊娠に至らなかった
症例で、次の採卵で顕微授精を予定する方
2) 本研究の概要や計画を説明し、同意を得らえた後、研究対象とする。
【除外基準】
不妊症(卵管性不妊、男
・高度乏精子症の男性不妊患者
性不妊、機能性不妊又
(原精液での総運動性精子数が10万未満総運動性精子数=液量(ml)×精子濃度(1mlあたり)×精
は一般不妊治療が無効
子運動率(%)で算出)
であるものに限る。)
・TESE/TESA/PESA の対象となる男性不妊症患者
・凍結融解精子を使用する患者
・非同意および上記の対象条件を満たさない方
・生殖補助医療治療計画書を作成時の女性年齢が43歳以上のカップル
・その他、研究責任医師又は研究分担医師等が本研究を安全に実施するのに不適当と判断した症
例
令5.3.1
本試験の目的は、「根治切除可能な食道扁平上皮癌において、Circulating tumor DNA(ctDNA)に
よる微小遺残腫瘍(Minimal residual disease, MRD)検査結果陰性群の無再発生存割合が設定した
無再発生存割合の閾値を上回ること」を示すことにより、ctDNAを用いて判定されたMRDの予後予
測因子としての有用性を明らかにすることである。
切除可能な進行食道扁平上皮癌 (cT1N1-3, T2N0-3, M0-1(頚部リンパ節のみ)) を対象とする。が
ん組織検体を治療前の生検時と手術検体から採取し、血液検体を治療前、NAC後、術後1ヶ月、術
後3ヶ月、術後6ヶ月の時点で採取する。組織検体(生検または手術検体)と血液検体の解析を行
い、組織と血液のデータを照合することで血中循環腫瘍DNA (circulating tumor DNA,ctDNA)を検
出し評価する。主要評価項目として、手術後ctDNA(-)群の1年無再発生存割合を評価する。
令6.3.1
子宮腺筋症(閉経前、か
子宮腺筋症病巣除去術は子宮温存を希望する子宮腺筋症患者に対して、妊孕性温存を目的として
つ、月経がある患者で
行う手術療法である。開腹・鏡視下に子宮腺筋症病巣を除去したのち、残存した組織を縫合・修復し
27 子宮腺筋症病巣除去術 あって、妊孕性の温存を
て子宮の形成・温存を行う。
希望するものに係るもの
に限る。)
令6.4.1
手術の概要は従来行われて来た腹腔鏡下子宮悪性腫瘍手術全摘術のステップで行う。
① 付属器の摘出
② 子宮の摘出
③ 必要に応じて腹腔鏡下に骨盤リンパ節の郭清および傍大動脈リンパ節の郭清
④ 大網の切除
卵巣がん、卵管がん、腹
⑤ 必要な症例には近接臓器合併切除
腹腔鏡下卵巣悪性腫瘍 膜がん又は境界悪性卵
28
(②③④⑤は症例に応じて行う)
手術
巣腫瘍(摘出が可能なも
(すでに付属器切除がされている場合、①は省略される)
のに限る。)
主要評価項目;手術日から 30 日以内の医療介入を必要とする周術期合併症(腸閉塞、感染、臓器
損傷等)の発生
副次評価項目;手術時間、術中出血量、輸血率、術中合併症の有無、術後合併症の有無、術後
QOL の評価
これらを検証し、腹腔鏡手術の安全性、有効性が開腹手術と同等であることを比較証明する。
令7.3.1
25
膜構造を用いた生理学
的精子選択術
血中循環腫瘍DNAを用
切除が可能な食道扁平
26 いた微小残存病変量の
上皮がん
測定
9
・過去に1回以上の流産歴があり、今回妊娠で臨床的に流産と診断された患者。子宮内に 流産胎
児、絨毛が残存している場合、または、体外に排出されたが流産胎児・絨毛を回収できた場合。
・今回妊娠で臨床的に死産と診断された患者。子宮内に死産胎児、絨毛が残存している場合、また
は、体外に排出されたが死産胎児・絨毛を回収できた場合。
2) 胎児(胎芽)・絨毛の採取
採取方法は下記の a)あるいは b)の手順にて行う。
a) 流死産物が体内に存在する場合
体内にある流死産物(胎児(胎芽)・絨毛)を子宮内容除去術(流産手術)、分娩誘発術または帝王
切開術により採取し、絨毛組織または胎児組織・胎児成分のみを分離する。
b) 流死産物が体外に排出された場合
体外へ排出された流死産物(胎児(胎芽)・絨毛)の組織から、絨毛組織・胎児成分のみを分離す
る。
24
流死産検体を用いた遺
伝子検査
自然流産(自然流産の既
往歴を有するもの)又は 分離した絨毛・胎児組織の一部を解析施設に移送し、NGS法にて解析する。
死産
3) 検査・解析
分離した絨毛・胎児組織の一部を解析施設であるタカラバイオ株式会社の衛生検査所に 移送し、
核酸抽出を行う。抽出核酸から Embgenix TM PGT-A Kit を用いて全ゲノム増幅、DNAライブラリー
の調製後、次世代シーケンサー(MiSeq System)を用いて塩基配列を決定する。得られた塩基配列
データから Embgenix TM Analysis Software を用いて染色体の数的異常、不均衡型構造異常を検
出する。
尚、分離した絨毛・胎児組織の一部を染色体G-banding法にも提出し、結果を比較する。
令4.12.1
4) 検査結果の判定と報告
(1)常染色体、性染色体のコピー数に有意の増加、減少が検出されないものを染色体正常核型と判
定する。
(2)解析結果を研究実施施設にて患者に説明する。染色体構造異常(転座など)が判明した場合は、
患者及びそのパートナーの染色体検査(G-banding法)を予定するが、その際には遺伝専門医など
による遺伝カウンセリングを実施する。
【選択基準】
・対象:本研究の対象者は、
1) 1回以上顕微授精を実施しても移植可能胚が得られず、または胚移植しても妊娠に至らなかった
症例で、次の採卵で顕微授精を予定する方
2) 本研究の概要や計画を説明し、同意を得らえた後、研究対象とする。
【除外基準】
不妊症(卵管性不妊、男
・高度乏精子症の男性不妊患者
性不妊、機能性不妊又
(原精液での総運動性精子数が10万未満総運動性精子数=液量(ml)×精子濃度(1mlあたり)×精
は一般不妊治療が無効
子運動率(%)で算出)
であるものに限る。)
・TESE/TESA/PESA の対象となる男性不妊症患者
・凍結融解精子を使用する患者
・非同意および上記の対象条件を満たさない方
・生殖補助医療治療計画書を作成時の女性年齢が43歳以上のカップル
・その他、研究責任医師又は研究分担医師等が本研究を安全に実施するのに不適当と判断した症
例
令5.3.1
本試験の目的は、「根治切除可能な食道扁平上皮癌において、Circulating tumor DNA(ctDNA)に
よる微小遺残腫瘍(Minimal residual disease, MRD)検査結果陰性群の無再発生存割合が設定した
無再発生存割合の閾値を上回ること」を示すことにより、ctDNAを用いて判定されたMRDの予後予
測因子としての有用性を明らかにすることである。
切除可能な進行食道扁平上皮癌 (cT1N1-3, T2N0-3, M0-1(頚部リンパ節のみ)) を対象とする。が
ん組織検体を治療前の生検時と手術検体から採取し、血液検体を治療前、NAC後、術後1ヶ月、術
後3ヶ月、術後6ヶ月の時点で採取する。組織検体(生検または手術検体)と血液検体の解析を行
い、組織と血液のデータを照合することで血中循環腫瘍DNA (circulating tumor DNA,ctDNA)を検
出し評価する。主要評価項目として、手術後ctDNA(-)群の1年無再発生存割合を評価する。
令6.3.1
子宮腺筋症(閉経前、か
子宮腺筋症病巣除去術は子宮温存を希望する子宮腺筋症患者に対して、妊孕性温存を目的として
つ、月経がある患者で
行う手術療法である。開腹・鏡視下に子宮腺筋症病巣を除去したのち、残存した組織を縫合・修復し
27 子宮腺筋症病巣除去術 あって、妊孕性の温存を
て子宮の形成・温存を行う。
希望するものに係るもの
に限る。)
令6.4.1
手術の概要は従来行われて来た腹腔鏡下子宮悪性腫瘍手術全摘術のステップで行う。
① 付属器の摘出
② 子宮の摘出
③ 必要に応じて腹腔鏡下に骨盤リンパ節の郭清および傍大動脈リンパ節の郭清
④ 大網の切除
卵巣がん、卵管がん、腹
⑤ 必要な症例には近接臓器合併切除
腹腔鏡下卵巣悪性腫瘍 膜がん又は境界悪性卵
28
(②③④⑤は症例に応じて行う)
手術
巣腫瘍(摘出が可能なも
(すでに付属器切除がされている場合、①は省略される)
のに限る。)
主要評価項目;手術日から 30 日以内の医療介入を必要とする周術期合併症(腸閉塞、感染、臓器
損傷等)の発生
副次評価項目;手術時間、術中出血量、輸血率、術中合併症の有無、術後合併症の有無、術後
QOL の評価
これらを検証し、腹腔鏡手術の安全性、有効性が開腹手術と同等であることを比較証明する。
令7.3.1
25
膜構造を用いた生理学
的精子選択術
血中循環腫瘍DNAを用
切除が可能な食道扁平
26 いた微小残存病変量の
上皮がん
測定
9