よむ、つかう、まなぶ。
総-9-1再生医療等製品「エレビジス点滴静注」の製造販売承認審査について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_68608.html |
| 出典情報 | 中央社会保険医療協議会 総会(第641回 1/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
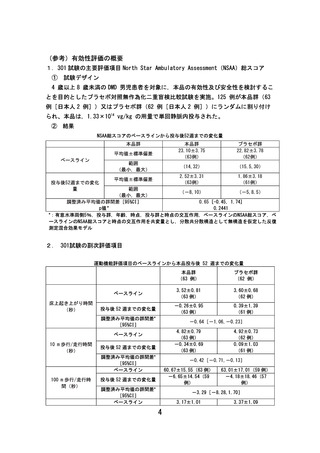
コアの変化には比較的大きな機能改善と時間を要する一方、起き上がり時
間や 10m歩行については、疾患進行に伴う微細な変化をより早期に捉えや
すい指標とされており、有効性を推定する根拠の一つになると評価した。
○
また、301 試験の対象年齢である4歳~7歳は、筋肉の成長に伴う機能向
上と疾患進行による機能低下が拮抗する時期であり、投与後 52 週までは、
NSAA 総スコアについて効果がマスクされ、群間差が現れにくかった可能性
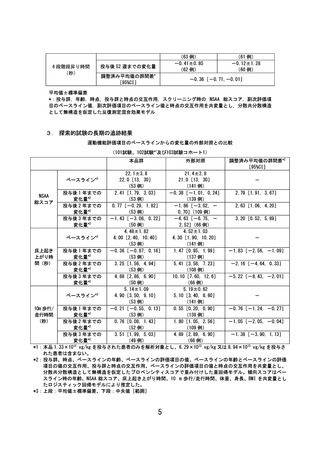
が考えられた。この点に関して、探索的試験(101 試験、102 試験及び 103
試験)における本品投与後3年時点の結果を外部対照データと比較したと
ころ、本品群での運動機能の低下は、外部対照と比較して緩徐であり、群
間差は時間経過に伴い大きくなる傾向が認められた。(参考資料3)
○
成長期が終わる時期までの長期追跡により、自然歴と比較して本品の効
果がより明瞭に観察されることが合理的に予測されると判断し、製造販売
後の有効性の検証として、301 試験で投与された患者について、本品投与後
3年間のデータを引き続き収集することで有効性の検証を行う計画は妥当
であると判断した。
○
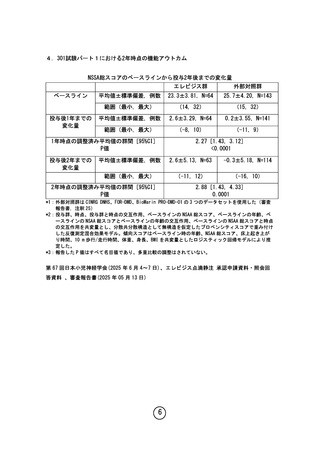
なお、301 試験における2年間の追跡結果が学会発表(※)されており、
外部コントロール群との比較において NSAA スコア等の統計学的な有意差が
示されている(多重性未調整)。(参考資料4)
(※)第 67 回日本小児神経学会
(2)条件期限付き承認後の情報
○ 令和7年9月 24 日、欧州委員会(European Commission;EC)は、本邦と
同様に歩行可能な DMD 患者を対象として申請された本品について、有効性が
十 分 に 証 明 さ れ て い な い と い う 見 解 か ら 、Conditional Marketing
Authorization(CMA)を不承認とする最終判断を行った。なお今後につい
ては、欧州の製造販売業者であるロシュ社が、欧州における承認取得に向
けて、欧州医薬品庁(European Medicines Agency;EMA)の見解を得るため
の当局相談を実施する計画である。
3.前 2 品目との比較について
○ 前 2 品目の審査後、令和6年3月に策定した「再生医療等製品に係る条件
及び期限付承認並びにその後の有効性評価計画策定に関するガイダンス」
に基づいて承認審査を行ったものであること。
2
間や 10m歩行については、疾患進行に伴う微細な変化をより早期に捉えや
すい指標とされており、有効性を推定する根拠の一つになると評価した。
○
また、301 試験の対象年齢である4歳~7歳は、筋肉の成長に伴う機能向
上と疾患進行による機能低下が拮抗する時期であり、投与後 52 週までは、
NSAA 総スコアについて効果がマスクされ、群間差が現れにくかった可能性
が考えられた。この点に関して、探索的試験(101 試験、102 試験及び 103
試験)における本品投与後3年時点の結果を外部対照データと比較したと
ころ、本品群での運動機能の低下は、外部対照と比較して緩徐であり、群
間差は時間経過に伴い大きくなる傾向が認められた。(参考資料3)
○
成長期が終わる時期までの長期追跡により、自然歴と比較して本品の効
果がより明瞭に観察されることが合理的に予測されると判断し、製造販売
後の有効性の検証として、301 試験で投与された患者について、本品投与後
3年間のデータを引き続き収集することで有効性の検証を行う計画は妥当
であると判断した。
○
なお、301 試験における2年間の追跡結果が学会発表(※)されており、
外部コントロール群との比較において NSAA スコア等の統計学的な有意差が
示されている(多重性未調整)。(参考資料4)
(※)第 67 回日本小児神経学会
(2)条件期限付き承認後の情報
○ 令和7年9月 24 日、欧州委員会(European Commission;EC)は、本邦と
同様に歩行可能な DMD 患者を対象として申請された本品について、有効性が
十 分 に 証 明 さ れ て い な い と い う 見 解 か ら 、Conditional Marketing
Authorization(CMA)を不承認とする最終判断を行った。なお今後につい
ては、欧州の製造販売業者であるロシュ社が、欧州における承認取得に向
けて、欧州医薬品庁(European Medicines Agency;EMA)の見解を得るため
の当局相談を実施する計画である。
3.前 2 品目との比較について
○ 前 2 品目の審査後、令和6年3月に策定した「再生医療等製品に係る条件
及び期限付承認並びにその後の有効性評価計画策定に関するガイダンス」
に基づいて承認審査を行ったものであること。
2