よむ、つかう、まなぶ。
総-9-1再生医療等製品「エレビジス点滴静注」の製造販売承認審査について (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_68608.html |
| 出典情報 | 中央社会保険医療協議会 総会(第641回 1/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
中医協 総-9-1
8 . 1 . 1 4
再生医療等製品「エレビジス点滴静注」の
製造販売承認審査について
医薬局医療機器審査管理課
1.背景
○ 「エレビジス点滴静注」(本品)については、令和7年4月 18 日の薬事審
議会再生医療等製品・生物由来技術部会において、製造販売承認の可否等
について審議し、5月 13 日に薬事承認(条件及び期限付き承認)を行った。
<エレビジス点滴静注>
製 造 販 売 業 者 :中外製薬株式会社
一 般 的 名 称 :デランジストロゲン モキセパルボベク
適
応
症 :デュシェンヌ型筋ジストロフィー
ただし、以下のいずれも満たす場合に限る
・抗 AAVrh74 抗体が陰性の患者
・歩行可能な患者
・3 歳以上 8 歳未満の患者
条件及び期限
該当(期限3年)
○
5月 14 日の中医協総会における、本品の保険適用に係る議論の進め方の
ご審議の中で、1号および2号委員から、
・本品の有効性推定の根拠と本承認の見通しについて、
・本品の審査が、過去に条件及び期限付き承認がなされた後に保険適用か
ら削除された2製品(ハートシート、コラテジェン)の課題を踏まえたも
のであるかについて、
説明がなされるべきとのご意見をいただいた。
2.本品の有効性の判断等について
(1)本品の承認審査について
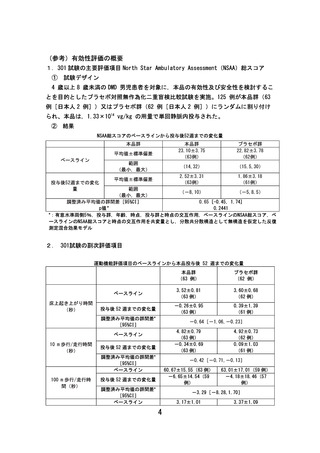
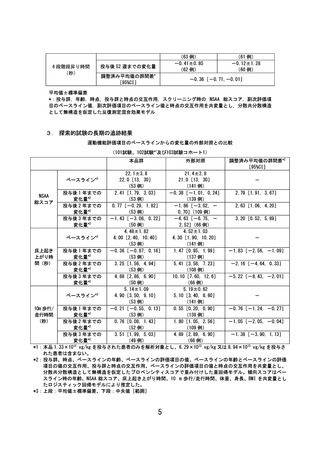
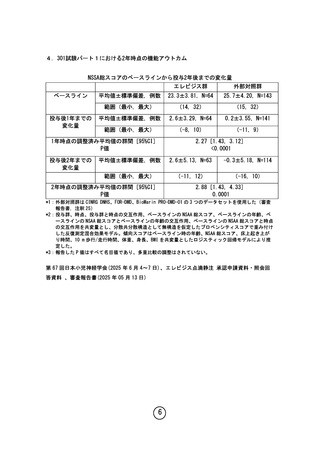
○ 第Ⅲ相試験である 301 試験では、主要評価項目である「NSAA 総スコア(※)
」
でプラセボ群に比較して優越性は示せなかった。一方で、副次評価項目であ
る「床上起き上がり時間」及び「10m歩行/歩行時間」等において、一定の
運動機能の改善または運動機能低下の抑制が期待できる結果が得られている。
(参考1及び2)
(※)4歳以上の DMD 男児における歩行能力を評価するために開発された機能尺度。
○ NSAA 総スコアは日常生活動作の達成度を段階的に評価する尺度であり、ス
1
8 . 1 . 1 4
再生医療等製品「エレビジス点滴静注」の
製造販売承認審査について
医薬局医療機器審査管理課
1.背景
○ 「エレビジス点滴静注」(本品)については、令和7年4月 18 日の薬事審
議会再生医療等製品・生物由来技術部会において、製造販売承認の可否等
について審議し、5月 13 日に薬事承認(条件及び期限付き承認)を行った。
<エレビジス点滴静注>
製 造 販 売 業 者 :中外製薬株式会社
一 般 的 名 称 :デランジストロゲン モキセパルボベク
適
応
症 :デュシェンヌ型筋ジストロフィー
ただし、以下のいずれも満たす場合に限る
・抗 AAVrh74 抗体が陰性の患者
・歩行可能な患者
・3 歳以上 8 歳未満の患者
条件及び期限
該当(期限3年)
○
5月 14 日の中医協総会における、本品の保険適用に係る議論の進め方の
ご審議の中で、1号および2号委員から、
・本品の有効性推定の根拠と本承認の見通しについて、
・本品の審査が、過去に条件及び期限付き承認がなされた後に保険適用か
ら削除された2製品(ハートシート、コラテジェン)の課題を踏まえたも
のであるかについて、
説明がなされるべきとのご意見をいただいた。
2.本品の有効性の判断等について
(1)本品の承認審査について
○ 第Ⅲ相試験である 301 試験では、主要評価項目である「NSAA 総スコア(※)
」
でプラセボ群に比較して優越性は示せなかった。一方で、副次評価項目であ
る「床上起き上がり時間」及び「10m歩行/歩行時間」等において、一定の
運動機能の改善または運動機能低下の抑制が期待できる結果が得られている。
(参考1及び2)
(※)4歳以上の DMD 男児における歩行能力を評価するために開発された機能尺度。
○ NSAA 総スコアは日常生活動作の達成度を段階的に評価する尺度であり、ス
1