よむ、つかう、まなぶ。
総-3参考7 (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_67369.html |
| 出典情報 | 中央社会保険医療協議会 総会(第636回 12/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
力症 1 例(0.2%)、脳炎 1 例(0.2%)
、神経障害(ギラン・バレー症候群を含む)4 例
(1.0%)、infusion reaction 4 例(1.0%)
、重度の皮膚障害 1 例(0.2%)
、膵炎 2 例(0.5%)
が認められた。また、重度の下痢、筋炎・横紋筋融解症、発熱性好中球減少症、消化管
穿孔、髄膜炎、免疫性血小板減少性紫斑病及び赤芽球癆は認められなかった。
【用法・用量】
本剤の母集団薬物動態解析モデルを用いたシミュレーションにより、PACIFIC 試験の
患者集団に本剤 10 mg/kg を Q2W 又は 1500 mg を Q4W で投与したときの血清中濃度が
検討された。また、本剤の曝露-反応解析モデルを用いたシミュレーションにより、
PACIFIC 試験の患者集団に本剤 10 mg/kg を Q2W 又は 1500 mg を Q4W で投与したとき
の OS が検討された。その結果、本剤 1500mg Q4W 投与時の Cmin,ss は、本剤 10 mg/kg
Q2W 投与時の Cmin,ss と比較して低値を示すと予測されたものの、10 mg/kg Q2W 投与と
1500 mg Q4W 投与との間で、OS に明確な差異は認められないと予測された。また、本
剤 1500 mg Q4W 投与時の Cmax,ss は、本薬 10 mg/kg Q2W 投与時の Cmax,ss と比較して高値
を示すと予測されたものの、PACIFIC 試験において本剤 10 mg/kg Q2W 投与した際の曝
露量と安全性との間に明確な関連は認められなかったこと及び進展型小細胞肺癌患者
に本薬 1500 mg Q4W 投与した際の曝露量と安全性との間に明確な関連は認められなか
ったことから、非小細胞肺癌患者においても本剤 1500 mg Q4W 投与は本剤 10 mg/kg
Q2W 投与と同様に忍容可能と考えられた。
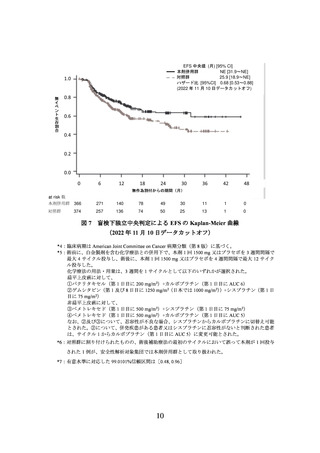
表3
PACIFIC 試験の患者集団において予測された本剤の PK パラメータ
用法・用量
患者数
AUCss (μgday/mL)
Cmax,ss (μg/mL)
Cmin,ss (μg/mL)
10 mg/kg Q2W
473
7633 (4695-11581)
365 (251-511)
160 (91.0-250)
1500 mg Q4W
473
8055 (4996-13326)
567 (400-827)
130 (65.4-238)
中央値(90%予測区間)
、AUCss:定常状態における投与後 28 日間の血清中濃度-時間曲線下面積、Cmin,ss:
定常状態における最低血清中濃度、Cmax,ss:定常状態における最高血清中濃度(点滴終了時点)
14
、神経障害(ギラン・バレー症候群を含む)4 例
(1.0%)、infusion reaction 4 例(1.0%)
、重度の皮膚障害 1 例(0.2%)
、膵炎 2 例(0.5%)
が認められた。また、重度の下痢、筋炎・横紋筋融解症、発熱性好中球減少症、消化管
穿孔、髄膜炎、免疫性血小板減少性紫斑病及び赤芽球癆は認められなかった。
【用法・用量】
本剤の母集団薬物動態解析モデルを用いたシミュレーションにより、PACIFIC 試験の
患者集団に本剤 10 mg/kg を Q2W 又は 1500 mg を Q4W で投与したときの血清中濃度が
検討された。また、本剤の曝露-反応解析モデルを用いたシミュレーションにより、
PACIFIC 試験の患者集団に本剤 10 mg/kg を Q2W 又は 1500 mg を Q4W で投与したとき
の OS が検討された。その結果、本剤 1500mg Q4W 投与時の Cmin,ss は、本剤 10 mg/kg
Q2W 投与時の Cmin,ss と比較して低値を示すと予測されたものの、10 mg/kg Q2W 投与と
1500 mg Q4W 投与との間で、OS に明確な差異は認められないと予測された。また、本
剤 1500 mg Q4W 投与時の Cmax,ss は、本薬 10 mg/kg Q2W 投与時の Cmax,ss と比較して高値
を示すと予測されたものの、PACIFIC 試験において本剤 10 mg/kg Q2W 投与した際の曝
露量と安全性との間に明確な関連は認められなかったこと及び進展型小細胞肺癌患者
に本薬 1500 mg Q4W 投与した際の曝露量と安全性との間に明確な関連は認められなか
ったことから、非小細胞肺癌患者においても本剤 1500 mg Q4W 投与は本剤 10 mg/kg
Q2W 投与と同様に忍容可能と考えられた。
表3
PACIFIC 試験の患者集団において予測された本剤の PK パラメータ
用法・用量
患者数
AUCss (μgday/mL)
Cmax,ss (μg/mL)
Cmin,ss (μg/mL)
10 mg/kg Q2W
473
7633 (4695-11581)
365 (251-511)
160 (91.0-250)
1500 mg Q4W
473
8055 (4996-13326)
567 (400-827)
130 (65.4-238)
中央値(90%予測区間)
、AUCss:定常状態における投与後 28 日間の血清中濃度-時間曲線下面積、Cmin,ss:
定常状態における最低血清中濃度、Cmax,ss:定常状態における最高血清中濃度(点滴終了時点)
14