よむ、つかう、まなぶ。
3 先進医療Bの総括報告書に関する評価について(別紙3-3)[1.3MB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第181回先進医療技術審査部会
別紙3-3
先進医療B
評価委員
令和7年11月13日
資料1-1
総括報告書に関する評価表(告示旧 42)
主担当:
蓮沼
副担当:
山本
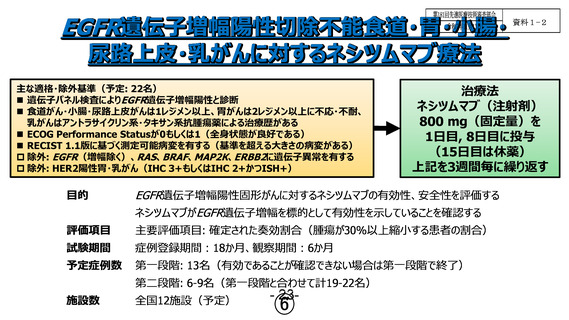
先 進 医 療 ネシツムマブ静脈内投与療法
の名称
申 請 医 療 名古屋大学医学部附属病院
機関
医 療 技 術 複数がん種において、EGFR(Epidermal growth factor receptor)遺
の概要
伝子増幅によりEGFRが異常活性し腫瘍が増殖すること、EGFR阻害薬
の有効性を示した非臨床・臨床データが複数報告されていることか
ら、EGFR遺伝子増幅はがん種横断的にドライバー遺伝子かつEGFR阻
害薬による治療標的になることが示唆されている。しかし、EGFR遺
伝子増幅陽性固形がんの頻度は低いことから、現在までに第III相試
験で有効性が示されたEGFR遺伝子増幅を標的とした治療法がなく、
がん種毎の標準治療が行われている。本研究では、標準治療に不応
もしくは不耐であるEGFR増幅陽 性食道・胃・小腸・尿路上皮・乳が
んを対象として、肺がんの治療薬であるネシツムマブを用いた多施
設共同第II相バスケット試験を行い、その有効性および安全性につ
いて評価する。
○主要評価項目:
客観的奏効割合(objective response rate: ORR)
① 腫瘍縮小効果判定を「固形がんの治療効果判定のための新ガイド
ライン(RECISTガイドライン)改訂版version 1.1―日本語訳日本臨
床腫瘍研究グループ(Japan Clinical Oncology Group: JCOG )版
―:Revised RECIST guideline(version 1.1)」に従って行う。
② 最良総合効果のcomplete response (CR)、partial response
(PR)の判定には、4週以上の効果持続期間による確定を必要とす
る。最良総合効果のstable disease (SD)の判定には、登録時から
6週時の判定まで総合効果がSDであることを必要とする。
1st~2nd stageで適格例19例中5例以上(22例全例が適格の場合は6
- 15-
1
別紙3-3
先進医療B
評価委員
令和7年11月13日
資料1-1
総括報告書に関する評価表(告示旧 42)
主担当:
蓮沼
副担当:
山本
先 進 医 療 ネシツムマブ静脈内投与療法
の名称
申 請 医 療 名古屋大学医学部附属病院
機関
医 療 技 術 複数がん種において、EGFR(Epidermal growth factor receptor)遺
の概要
伝子増幅によりEGFRが異常活性し腫瘍が増殖すること、EGFR阻害薬
の有効性を示した非臨床・臨床データが複数報告されていることか
ら、EGFR遺伝子増幅はがん種横断的にドライバー遺伝子かつEGFR阻
害薬による治療標的になることが示唆されている。しかし、EGFR遺
伝子増幅陽性固形がんの頻度は低いことから、現在までに第III相試
験で有効性が示されたEGFR遺伝子増幅を標的とした治療法がなく、
がん種毎の標準治療が行われている。本研究では、標準治療に不応
もしくは不耐であるEGFR増幅陽 性食道・胃・小腸・尿路上皮・乳が
んを対象として、肺がんの治療薬であるネシツムマブを用いた多施
設共同第II相バスケット試験を行い、その有効性および安全性につ
いて評価する。
○主要評価項目:
客観的奏効割合(objective response rate: ORR)
① 腫瘍縮小効果判定を「固形がんの治療効果判定のための新ガイド
ライン(RECISTガイドライン)改訂版version 1.1―日本語訳日本臨
床腫瘍研究グループ(Japan Clinical Oncology Group: JCOG )版
―:Revised RECIST guideline(version 1.1)」に従って行う。
② 最良総合効果のcomplete response (CR)、partial response
(PR)の判定には、4週以上の効果持続期間による確定を必要とす
る。最良総合効果のstable disease (SD)の判定には、登録時から
6週時の判定まで総合効果がSDであることを必要とする。
1st~2nd stageで適格例19例中5例以上(22例全例が適格の場合は6
- 15-
1