よむ、つかう、まなぶ。
(別紙2)[979KB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00110.html |
| 出典情報 | 先進医療会議(第148回 11/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
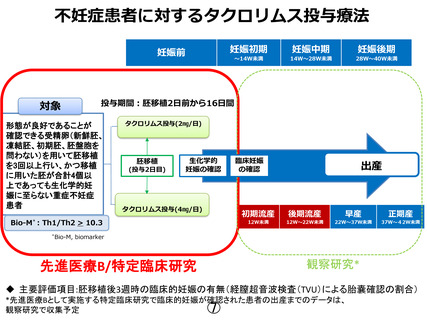
○主要評価項目:
【安全性評価基準】
異所性妊娠(疑いを含む)、有害事象及び副作用の発現頻度とその
程度、発現割合、件数を求め、一覧表を作成する。
有害事象について以下を集計する。
・有害事象が少なくとも 1 件発現した被験者数及び発現割合
・各有害事象の発現者数及び発現割合、件数
・重症度別の有害事象の発現者数及び発現割合
【有効性評価基準】
胚移植後 3 週もしくは 4 週時の臨床的妊娠の有無(経膣超音波検査
(TVU)による子宮内の胎嚢確認の割合)
胚移植後 3 週に胎嚢確認が出来なかった場合には、胚移植後 4 週
時に生化学的妊娠の有無と胎嚢確認を行う。胎嚢確認された場合に
は臨床的妊娠とするが、確認されずに hCG 値が生化学的妊娠判定日
の値を超えている場合には「異所性妊娠疑い」とし、安全性評価を行
う。その後の経過は観察研究で評価し、有害事象の収集を行う。
○副次評価項目:
【安全性評価基準】
胎嚢が確認された被験者および異所性妊娠疑いと判定された被験者
に関しては、その後、出産までの経過を観察する観察研究の中で、異
所性妊娠、流産、胎児奇形を含む胎児異常、早産、子宮内胎児発育不
全、妊娠高血圧症候群などの発生に関する情報を集める。
【有効性評価基準】
胚移植後 2 週時の生化学的妊娠(hCG)の有無(hCG 20 IU/L 以上の割
合)
(異所性妊娠は 20 IU/L 以上でも「生化学的妊娠」から除外する。)
○目標症例数:
26 例(登録症例数:26 例)
○試験期間:
2022年8月~2025年9月
2
【安全性評価基準】
異所性妊娠(疑いを含む)、有害事象及び副作用の発現頻度とその
程度、発現割合、件数を求め、一覧表を作成する。
有害事象について以下を集計する。
・有害事象が少なくとも 1 件発現した被験者数及び発現割合
・各有害事象の発現者数及び発現割合、件数
・重症度別の有害事象の発現者数及び発現割合
【有効性評価基準】
胚移植後 3 週もしくは 4 週時の臨床的妊娠の有無(経膣超音波検査
(TVU)による子宮内の胎嚢確認の割合)
胚移植後 3 週に胎嚢確認が出来なかった場合には、胚移植後 4 週
時に生化学的妊娠の有無と胎嚢確認を行う。胎嚢確認された場合に
は臨床的妊娠とするが、確認されずに hCG 値が生化学的妊娠判定日
の値を超えている場合には「異所性妊娠疑い」とし、安全性評価を行
う。その後の経過は観察研究で評価し、有害事象の収集を行う。
○副次評価項目:
【安全性評価基準】
胎嚢が確認された被験者および異所性妊娠疑いと判定された被験者
に関しては、その後、出産までの経過を観察する観察研究の中で、異
所性妊娠、流産、胎児奇形を含む胎児異常、早産、子宮内胎児発育不
全、妊娠高血圧症候群などの発生に関する情報を集める。
【有効性評価基準】
胚移植後 2 週時の生化学的妊娠(hCG)の有無(hCG 20 IU/L 以上の割
合)
(異所性妊娠は 20 IU/L 以上でも「生化学的妊娠」から除外する。)
○目標症例数:
26 例(登録症例数:26 例)
○試験期間:
2022年8月~2025年9月
2