資料4-2 製造販売業者からの国内副作用等報告の状況[5.0MB] (513 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64439.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和7年度第2回 10/24)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
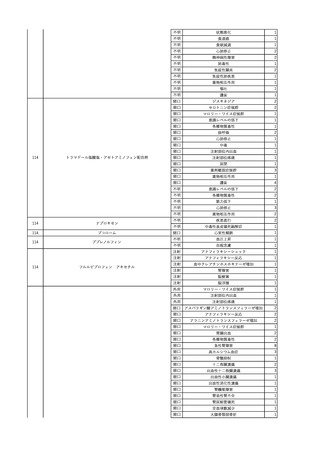
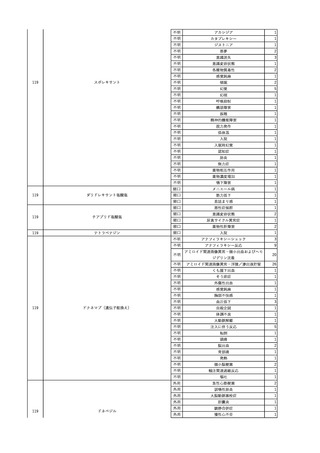
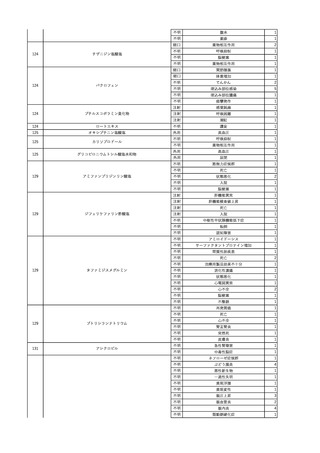
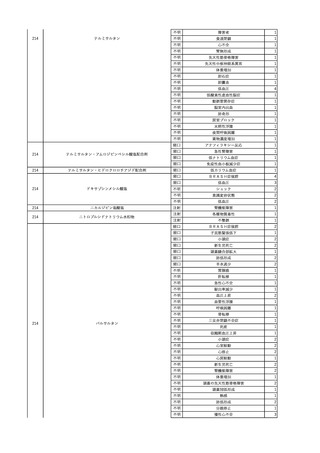
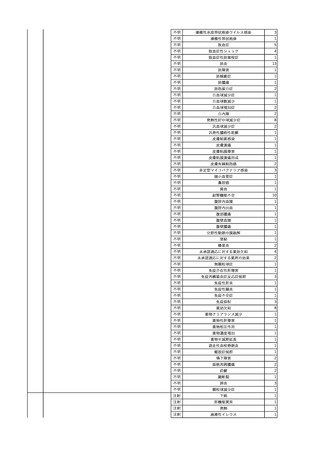
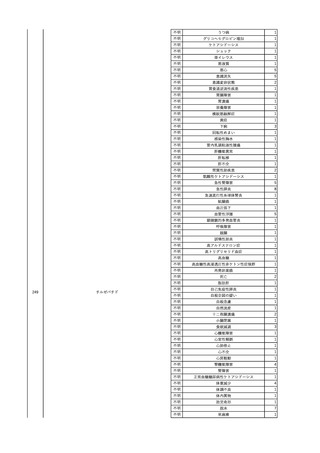
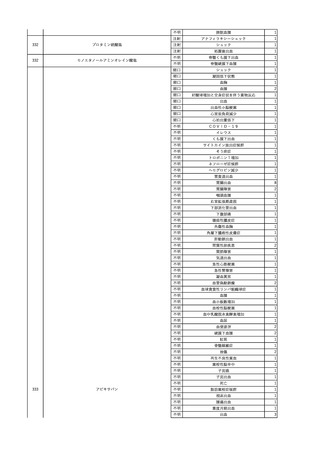
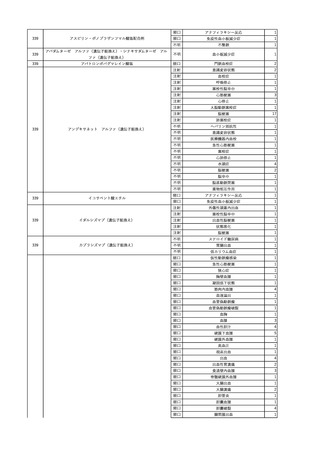
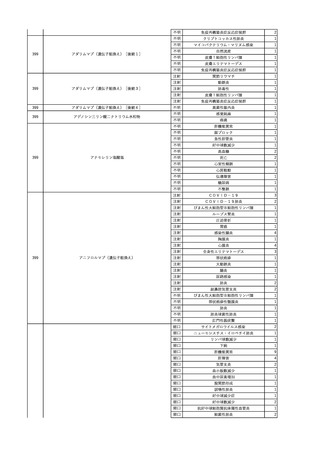
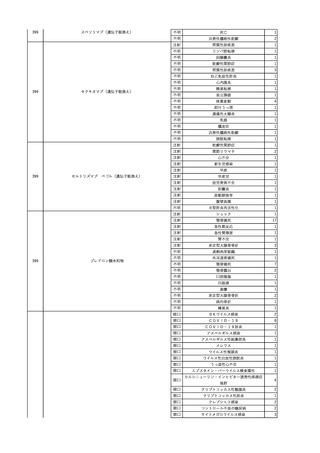
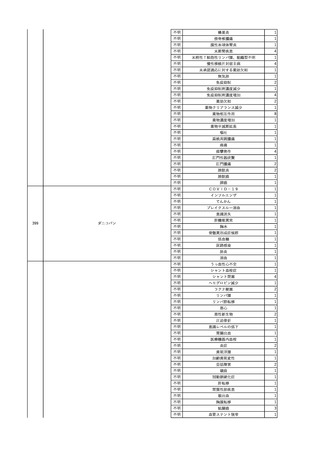
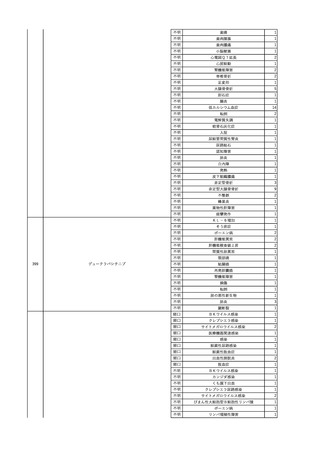
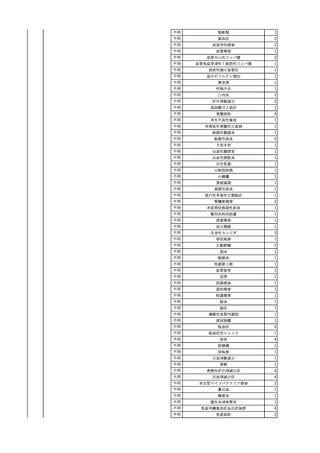
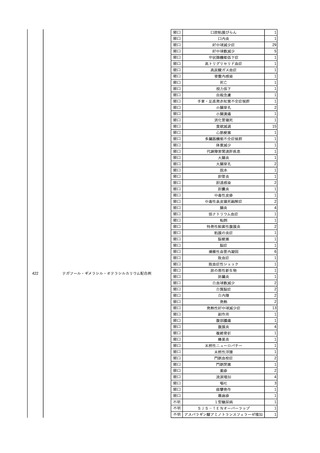
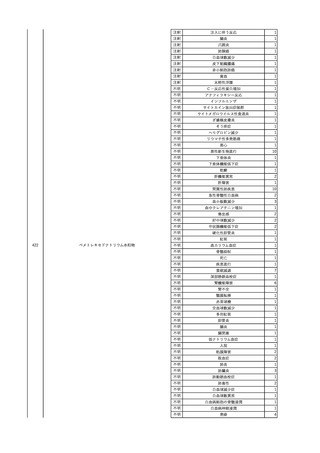
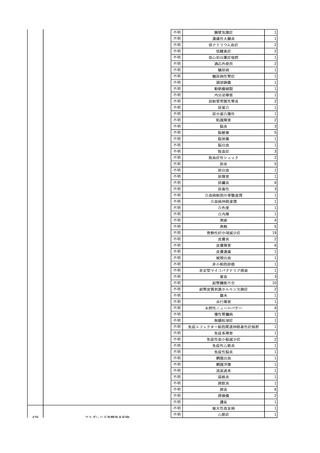
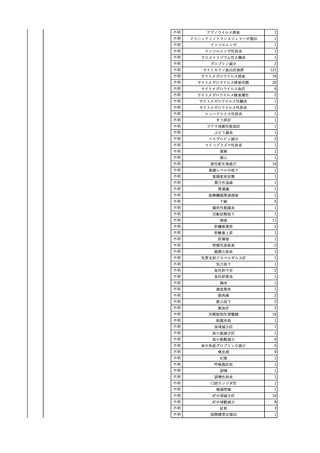
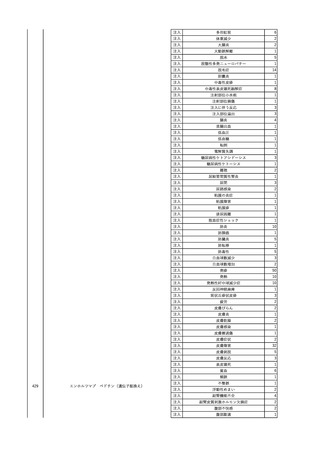
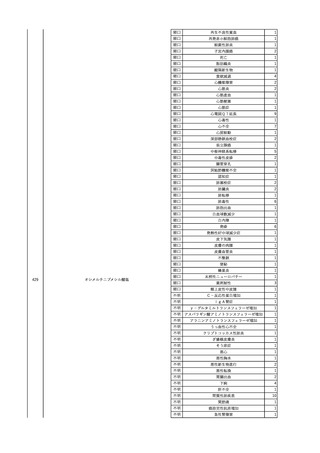
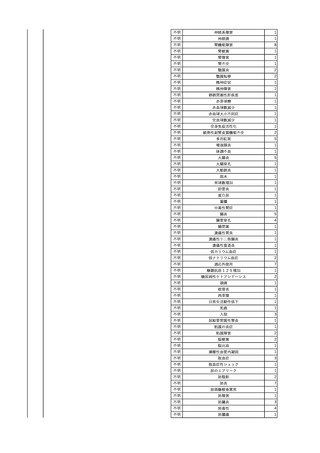
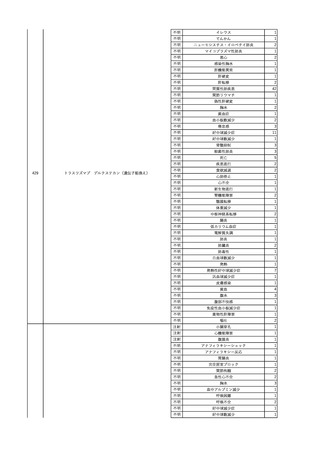
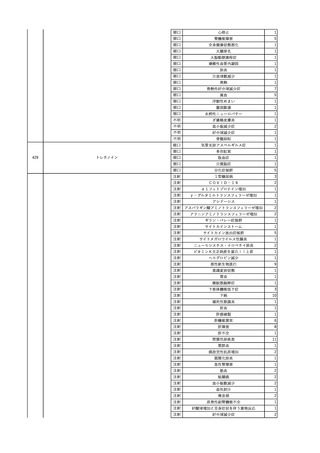
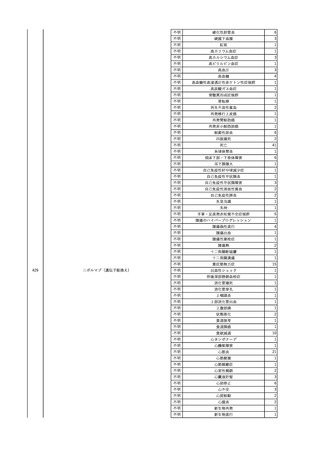
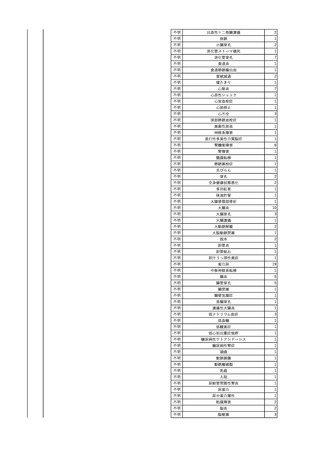
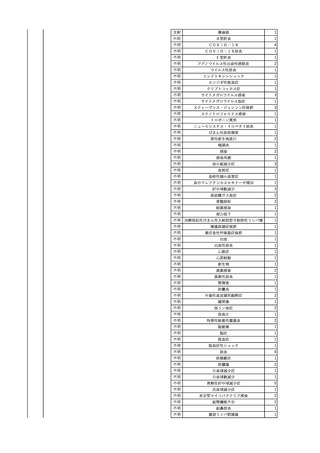
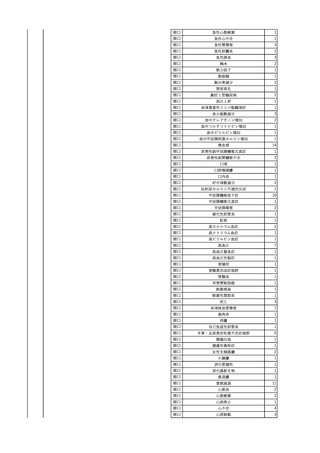
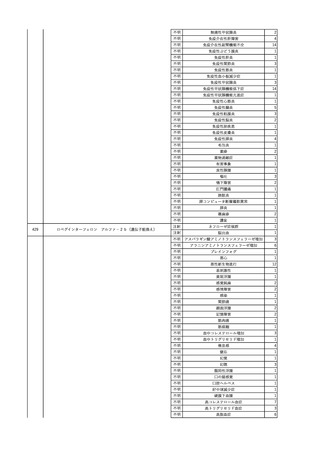
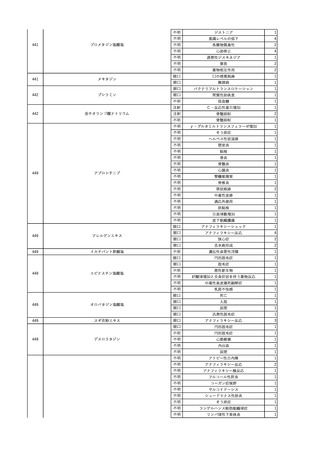
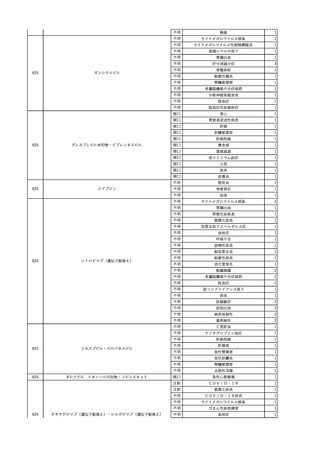
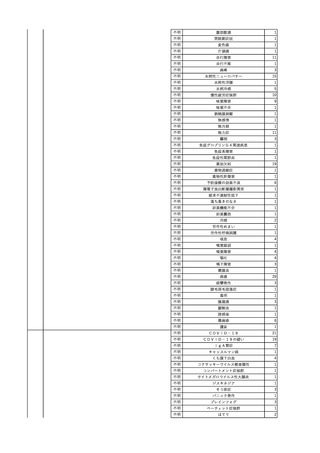
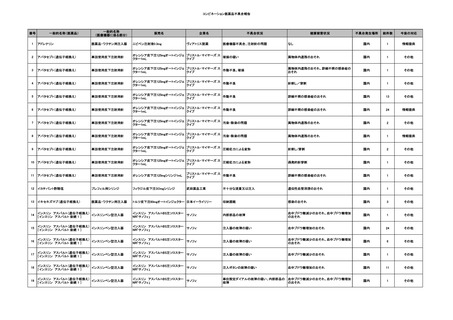
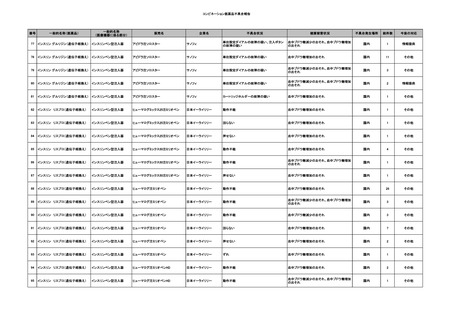
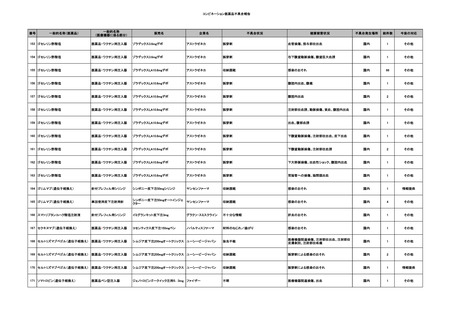
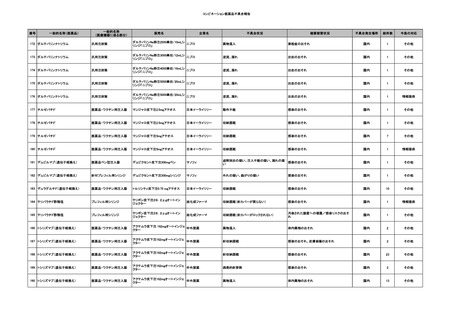
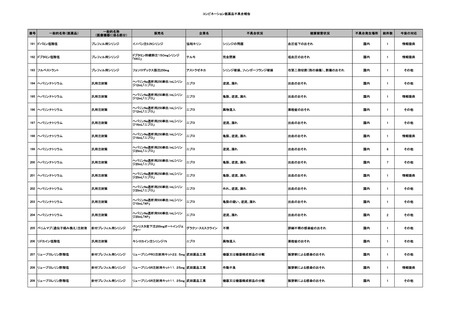
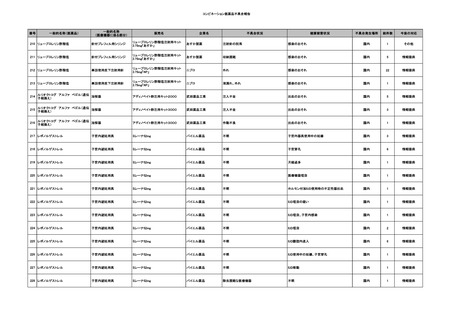
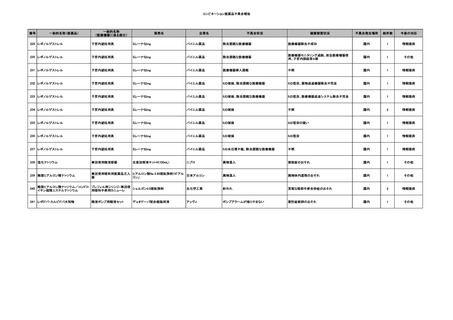
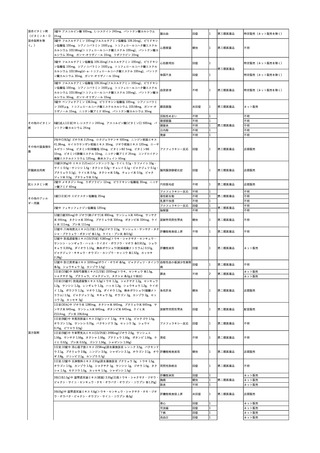
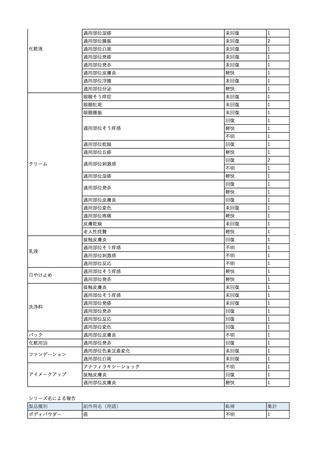
No.
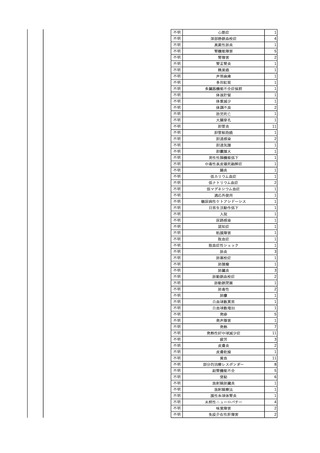
報告受領日
1
販売名(一般名)
患者性別
赤血球液-LR(人赤血球
液)
照射赤血球液-LR(人赤血
球液(放射線照射))
2025/4/3
女
新鮮凍結血漿-LR(新鮮凍
結人血漿)
照射濃厚血小板-LR(人血
小板濃厚液(放射線照射))
年代
原疾患(簡略名)
感染症名
投与年月
投与前検査(年月)
投与後検査(年月)
企業投与前検査(年月)
企業投与後検査(年月)
受血者個別NAT
(検体なし)
HCV-RNA(+)、HCVAb(+)
(25/01)
陽性(輸血後)
HBV-DNA(-)、HBsAg(-)、HBsAb
(-)、HBcAb(-)
(24/05)
HBV-DNA(+)、HBsAg(+)、HBsAb
(-)、HBcAb(+)
(25/04)
陰性(輸血前)
陽性(輸血後)
4名の個別NATは
HBV-DNA(-)
-
-
-
-
HCVAb(+)
(15/07)
70 循環器疾患
C型肝炎
14/11-15/01
HCVAb(-)
(14/11)
HCVAb(+)
(18/03)
HCV-RNA(+)、HCVAb(+)
(25/02)
献血者個別NAT
備考
18名のHCV-RNA
(-)、11名の当該及
び次回献血時のスク
リーニング個別NATは
HCV-RNA(-)、2名の
個別NATは保管検体
の保管年限が過ぎて
おり、検査実施でき
ず。
HBV-DNA(-)
(24/08)
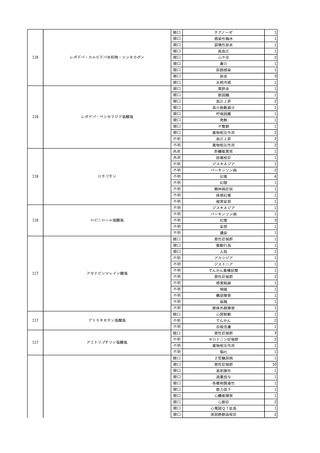
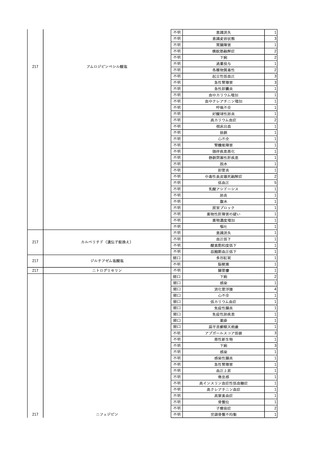
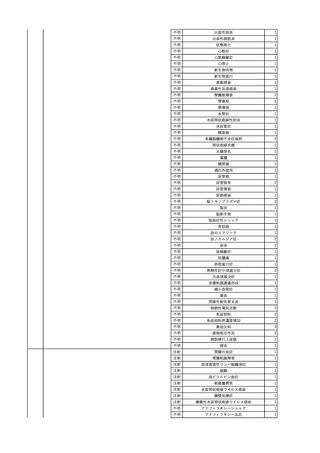
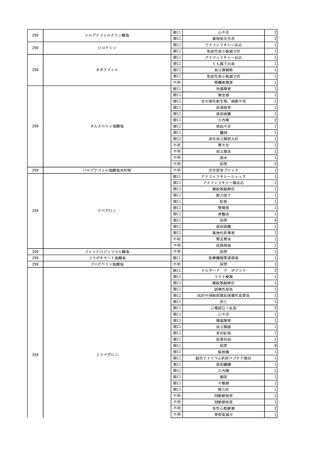
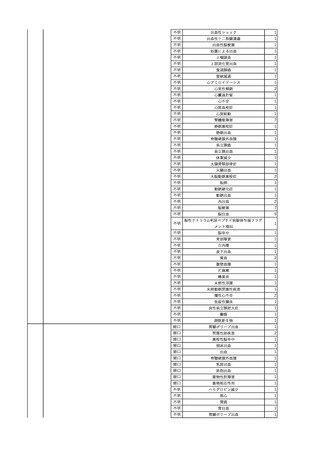
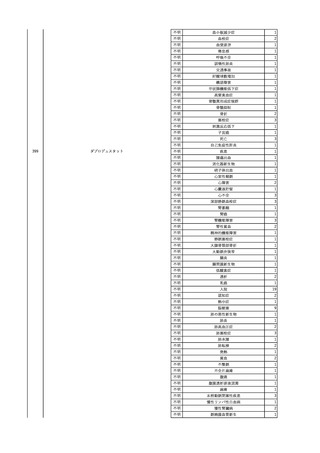
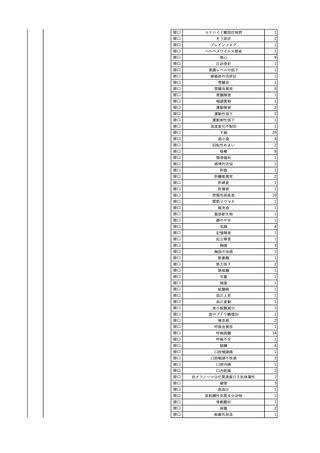
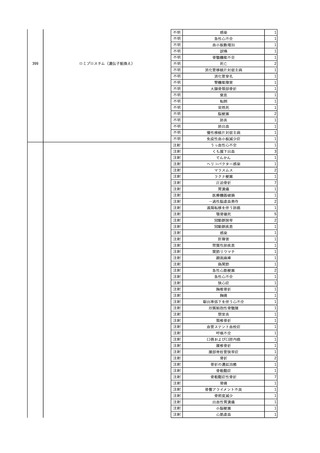
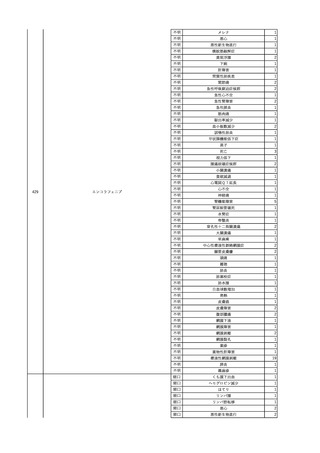
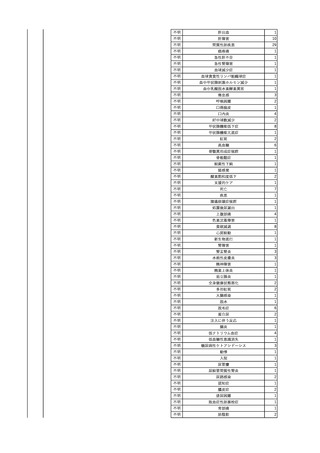
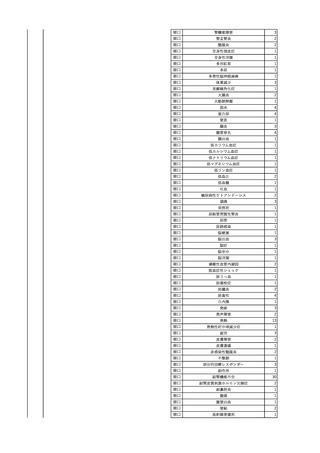
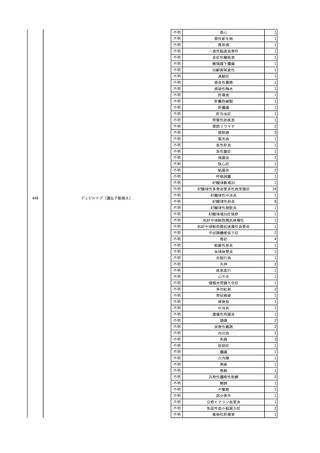
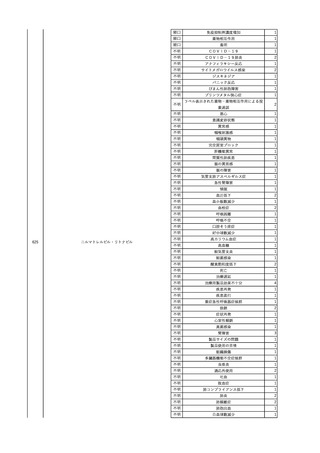
2
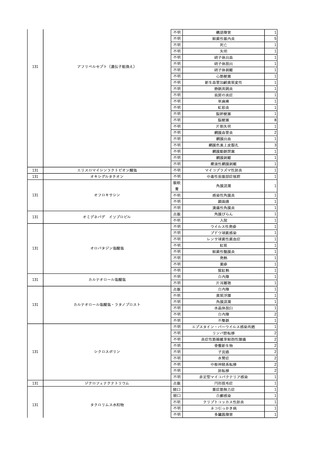
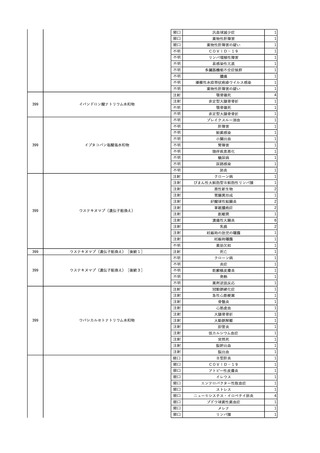
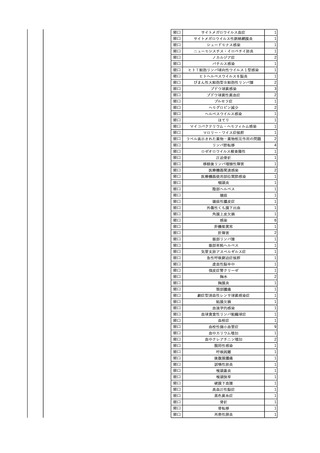
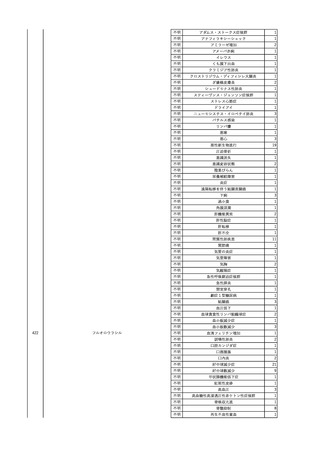
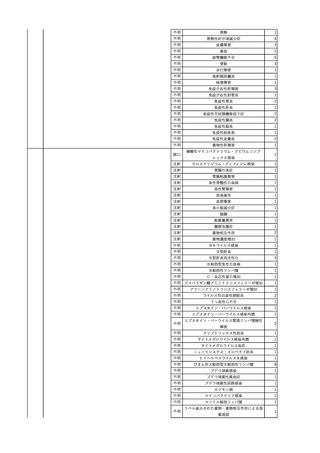
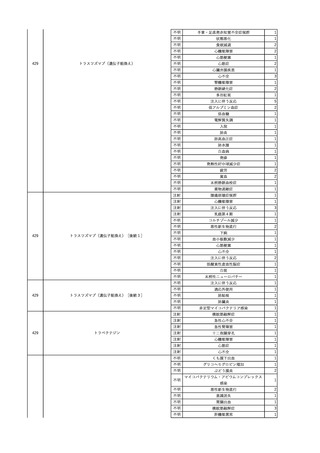
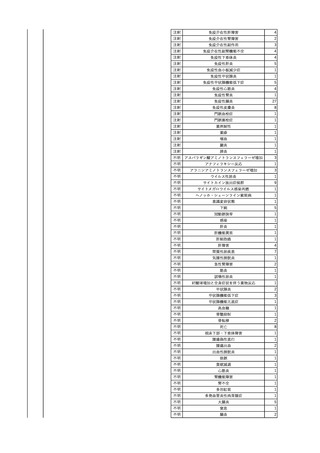
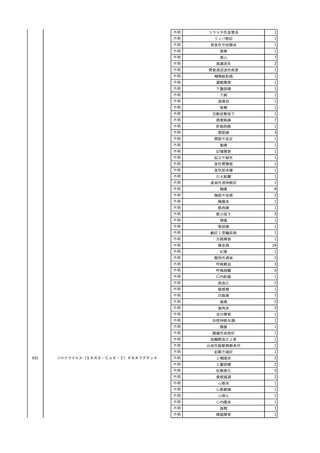
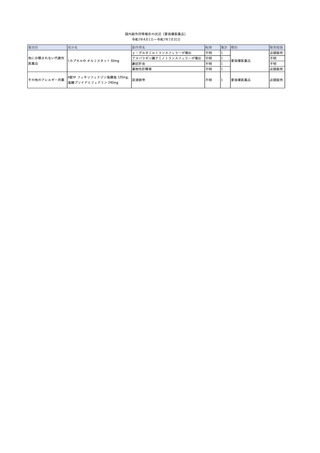
2025/4/18
照射赤血球液-LR(人赤血
女
球液(放射線照射))
外傷・整形外科的疾患
循環器疾患
70
糖尿病
その他の疾患
HBsAg(-)
(24/05)
B型肝炎
24/05
HBsAb(-)、HBcAb(-)
(24/05)
HBV-DNA(-)
(24/10)
HBsAg(-)
(25/01)
HBsAg(+)、HBsAb(-) 、HBcAb(+)
(25/04)
HBV-DNA(+)
(25/04)
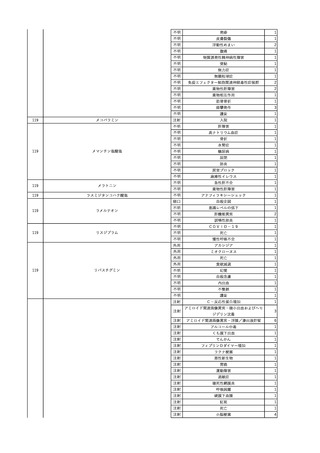
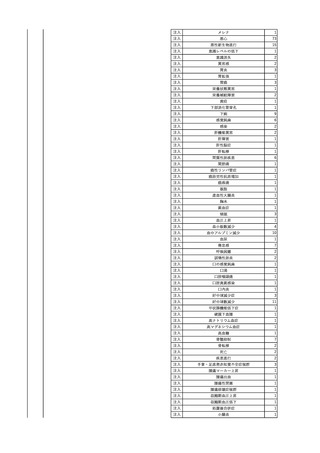
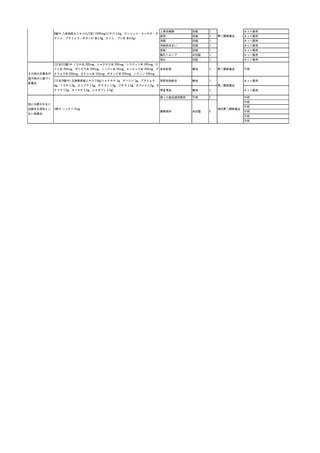
輸血開始40分後 血圧低下、酸素化悪化出現。
輸血開始1時間40分後 BP 90/53 mmHg、HR 108 /min、SpO2 90%(O2投与下)。
輸血開始2時間40分後 胸部X線検査にて、右肺炎所見あり。SpO2 80%(FiO2 100%)。
輸血開始3時間40分後 BT 38.2℃、BP 86/56 mmHg、HR 142 /min、SpO2 79%(O2投与下)。
輸血開始4時間40分後 血液培養検査実施、経気管吸引物採取。
セフェピム塩酸塩水和物投与開始。
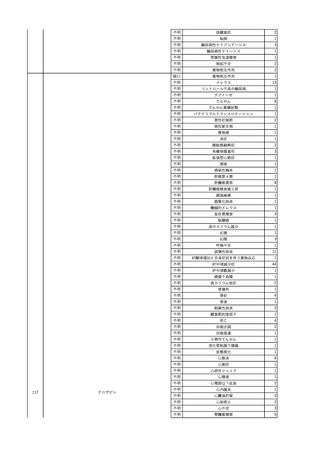
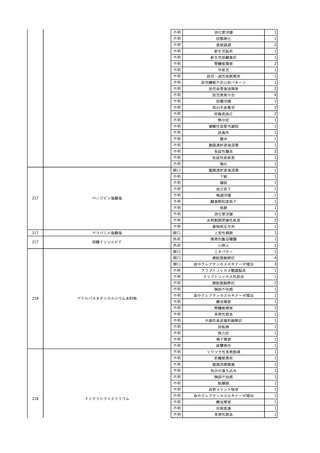
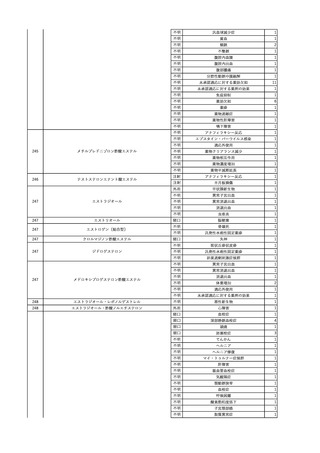
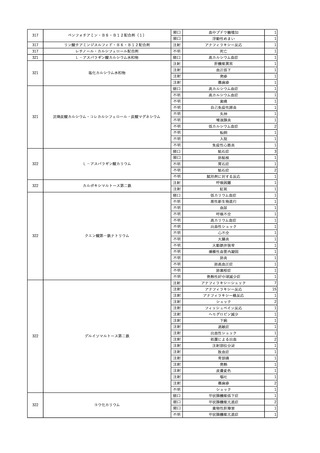
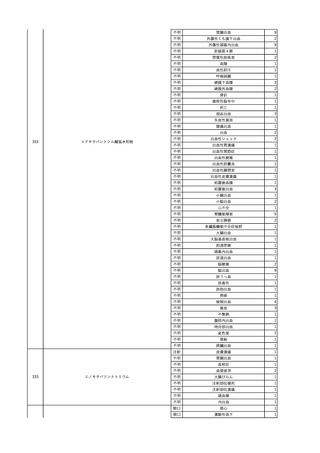
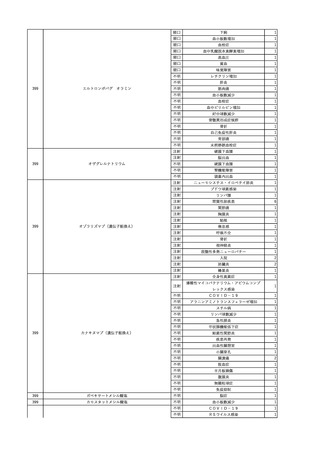
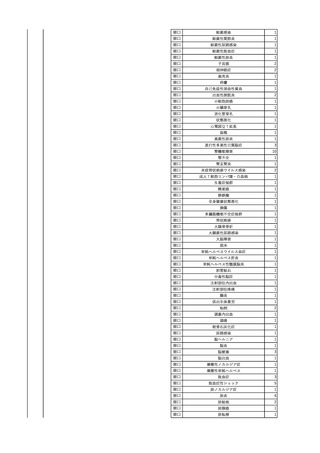
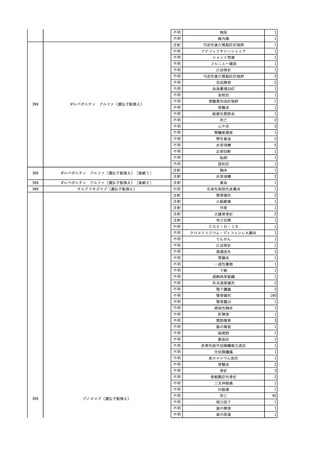
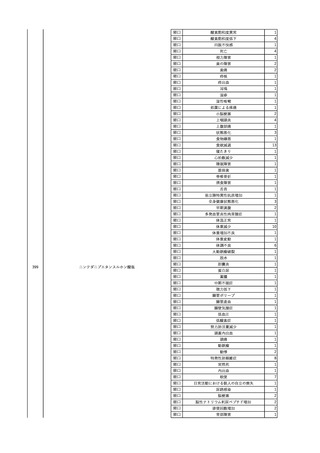
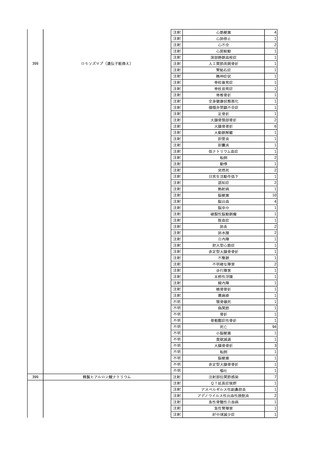
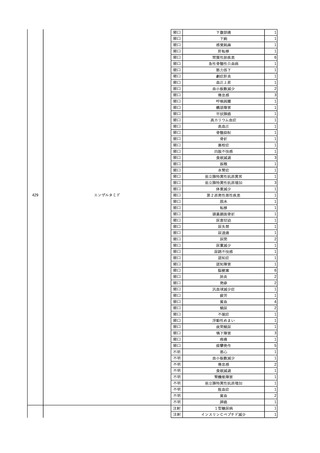
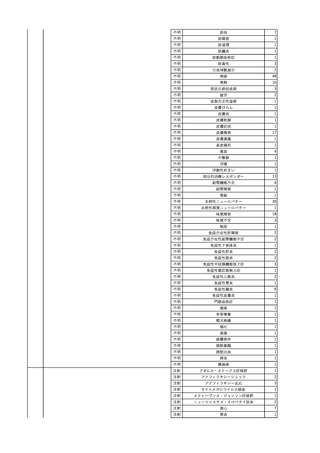
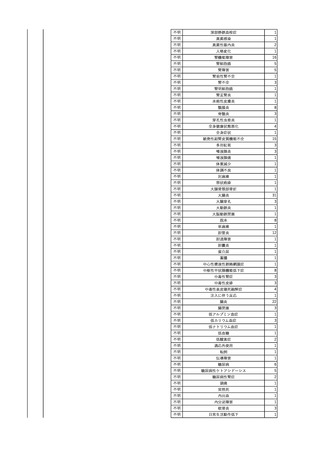
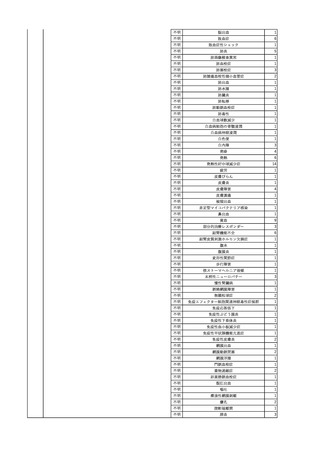
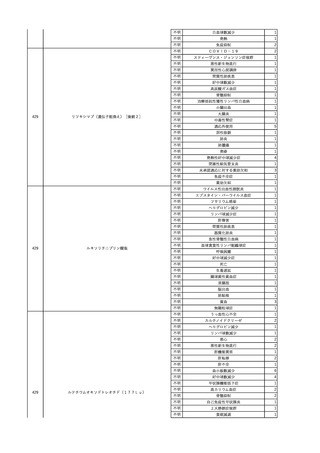
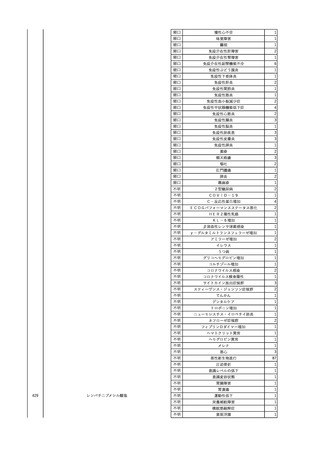
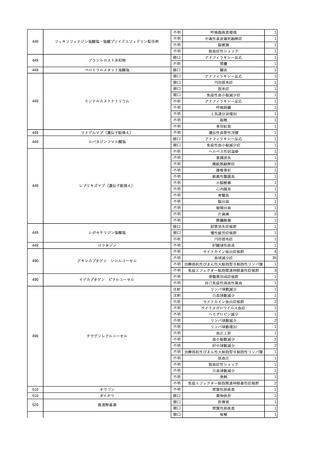
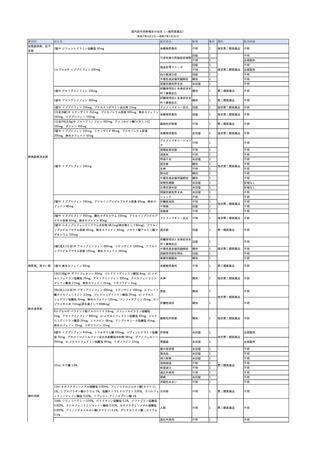
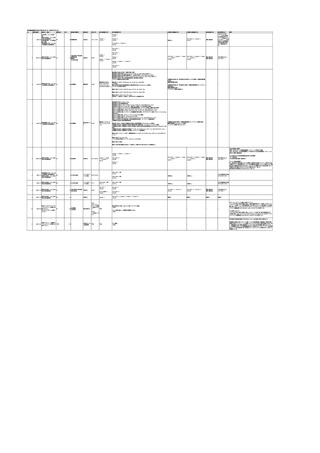
3
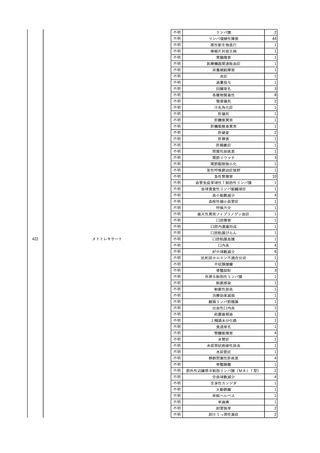
照射洗浄血小板-LR(人血
2025/6/5
女
小板濃厚液(放射線照射))
40 血液腫瘍
細菌感染
25/06
当該輸血用血液と同一採血番号の使用済みバッグ内残渣にて細菌培養試験
を実施。
細菌培養試験:陰性
輸血開始20分前 BT
輸血翌日 BT 38.8℃、BP 89/58 mmHg、HR 150 /min、SpO2 86%。
38.2℃、BP 122/58
ECMO導入。
mmHg、HR 91 /min、
輸血日実施の患者血液培養検査及び経気管吸引物よりEscherichia coli を検出。
SpO2 94%(O2投与下)。 メロペネム水和物投与開始。
当該輸血用血液と同一採血番号の血漿にて細菌培養試験及びエンドトキシン
試験を実施。
細菌培養試験:陰性
エンドトキシン試験:基準値以下
輸血2日後 BT 35.3℃、BP 60/53 mmHg、HR 132 /min、SpO2 71%。
輸血3日後 BT 35.4℃、BP 69/59 mmHg、HR 129 /min、SpO2 76%。
輸血4日後 BT 35.6℃、BP 21/20 mmHg。
菌血症にて、患者死亡。剖検なし。副作用と死亡との関連性不明。
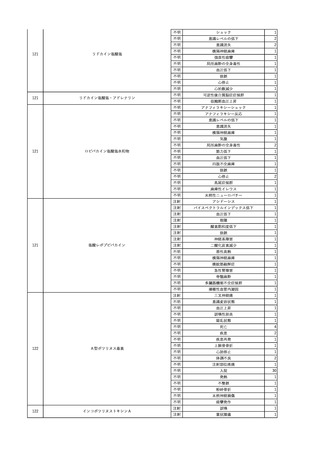
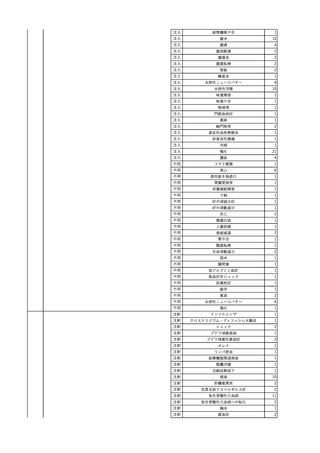
輸血開始6分後 BP 129/97 mmHg。
輸血開始22分後 悪寒戦慄出現。
輸血開始25分後 BT 36.2℃、BP 82/71 mmHg、HR 94 /min、SpO2 90%(O2 3 L/min)。
輸血開始26分後 BP 67 mmHgに低下。輸血中止。酢酸リンゲル液全開投与開始。
輸血中止16分後 BP 142/102 mmHg。血液培養検査実施。メロペネム水和物1 g静脈内投与開始。
輸血中止1時間2分後 BT 40.3℃、BP 142/99 mmHg、HR 142 /min、SpO2 94%(O2 3 L/min)。
輸血中止2時間28分後 BT 40.0℃、BP 70/41 mmHg、HR 133 /min、SpO2 92%(O2 4 L/min)。
輸血中止2時間42分後 ノルアドレナリン持続静脈内投与開始。ヒドロコルチゾンリン酸エステルナトリウム100 mg
静脈内投与。
輸血中止3時間1分後 ノルアドレナリン0.14 μg/kg/minまで増量。
輸血中止3時間21分後 BP 119/86 mmHg。ICU入室。
輸血中止5時間38分後 BT 39℃、BP 96/75 mmHg、HR 122 /min、SpO2 95%(O2 5 L/min)。
輸血中止9時間35分後 発熱持続。血液培養検査再度実施。バンコマイシン塩酸塩開始。
当該輸血用血液の血液培養検査実施。
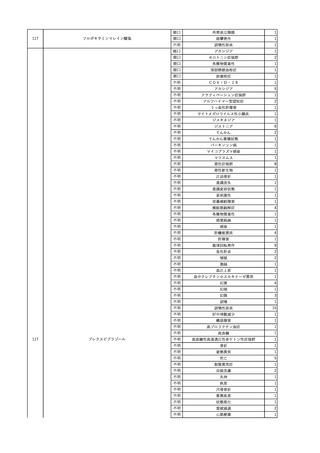
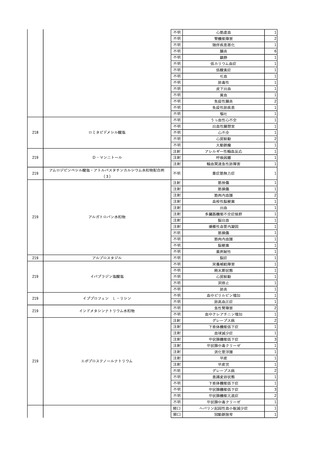
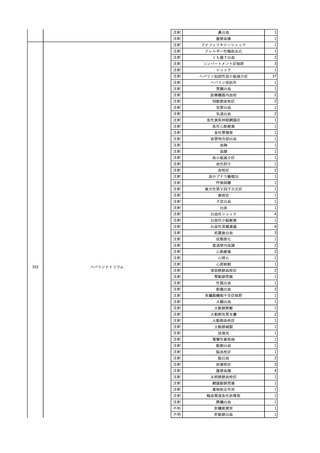
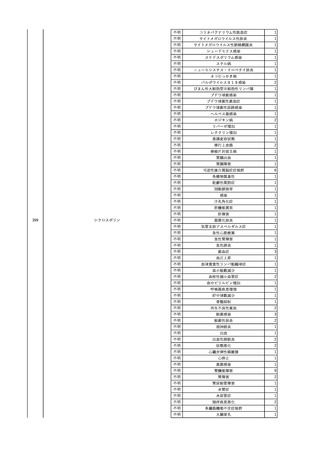
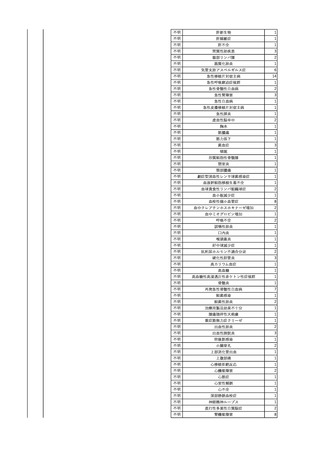
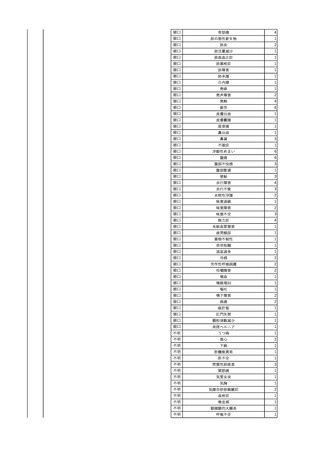
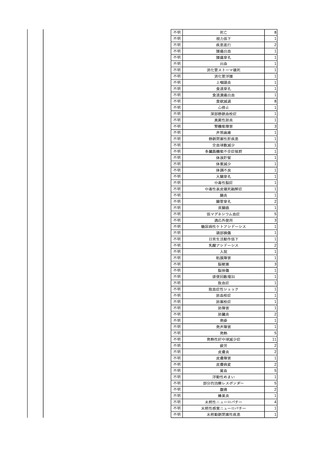
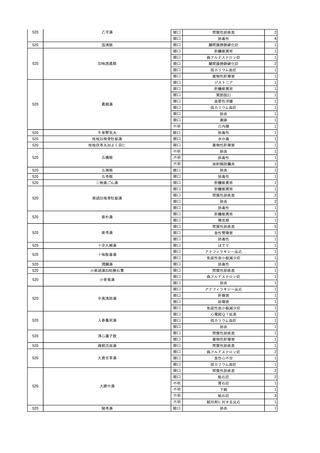
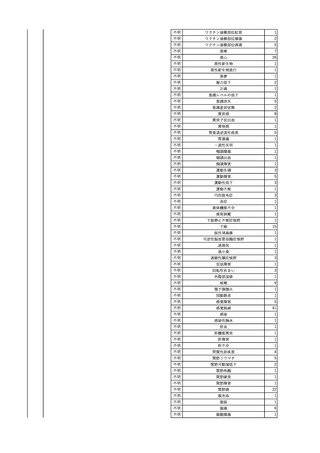
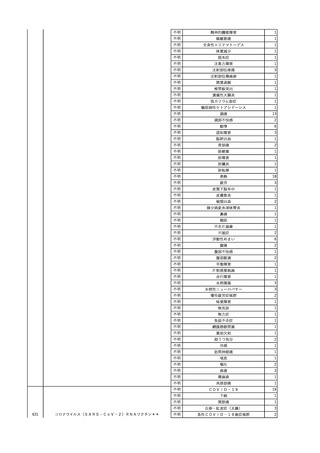
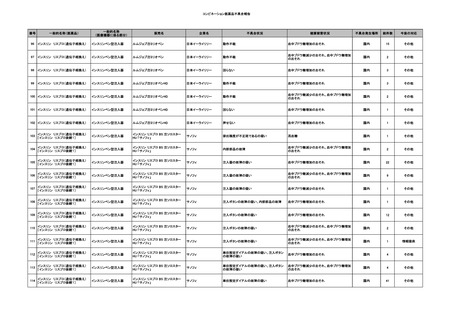
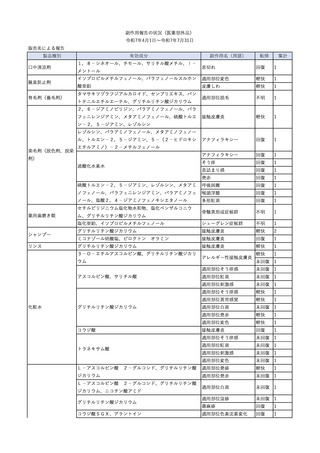
4
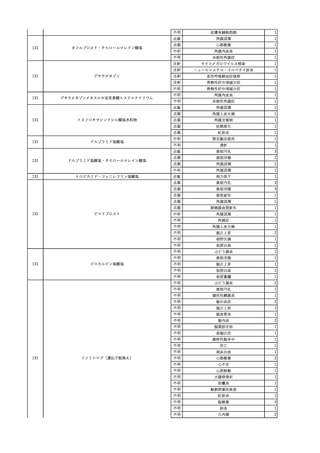
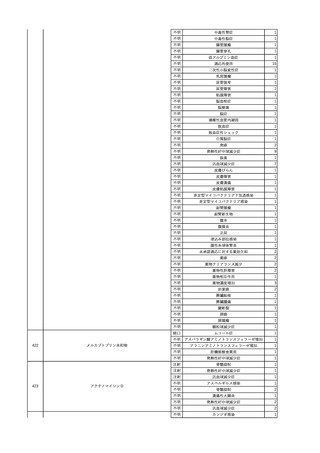
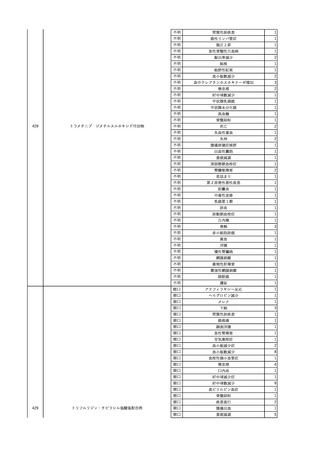
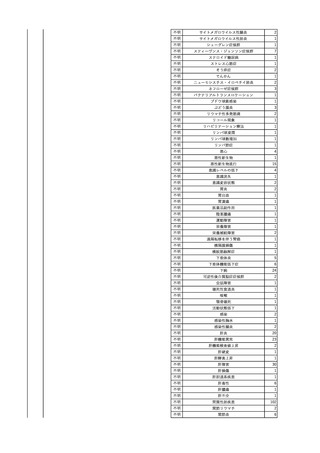
2025/6/6
照射濃厚血小板-LR(人血
男
小板濃厚液(放射線照射))
50 血液腫瘍
敗血症性ショッ
25/06
ク
輸血前 BT 36.6℃、BP
125/97 mmHg、HR 83
/min。
輸血翌日 院内にて実施の当該輸血用血液の血液培養検査よりEscherichia coli を検出。
当該輸血用血液から細菌検出6時間後 播種性血管内凝固合併。トロンボモデュリンアルファ開始。
当該輸血用血液から細菌検出7時間45分後 輸血日実施の患者血液培養検査の4本中3本よりEscherichia coli を
検出。
当該輸血用血液から細菌検出8時間後 BT 37.0℃、BP 122/86 mmHg、HR 91 /min、SpO2 97%(O2 2 L/min)。
当該輸血用血液から細菌検出10時間後 ノルアドレナリン漸減開始。
当該輸血用血液の残余にて細菌培養試験及びエンドトキシン試験を実施。
細菌培養試験:Escherichia coli を検出
エンドトキシン試験:2000 pg/mL以上
輸血2日後 ノルアドレナリン終了。循環動態安定。BT 36.9℃、BP 125/92 mmHg、HR 89 /min、SpO2 96%(O2 1
L/min)。
輸血3日後 BP 131/104 mmHg。
バイタル測定2時間後 BT 37.1℃、HR 83 /min、SpO2 90%。
輸血5日後 ICU退室。
輸血16日後 急性骨髄性白血病にて、患者死亡。剖検不明。副作用と死亡との関連性なし。
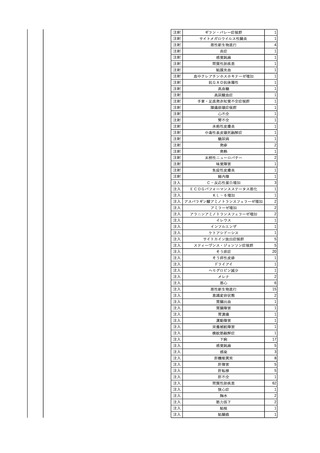
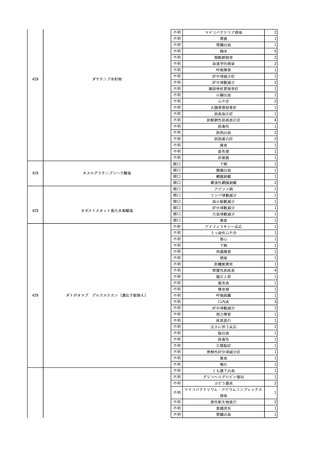
【献血者陽転化情報】
当該 2024年12月 HBV関連検査陰性、スクリーニング個別NAT陰性
次回 2025年6月 HBs抗原検査陰性、HBc抗体及びHBs抗体検査陽性、スクリーニング
個別NAT陰性(陽転献血)
HBsAg(+)、HBsAb(-)、HBcAb(+)
(25/06)
5
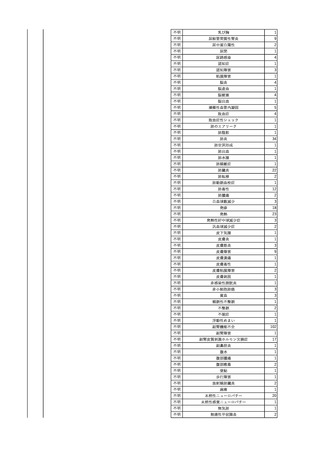
2025/6/25
照射赤血球液-LR(人赤血
女
球液(放射線照射))
70 血液疾患
B型肝炎
24/12-25/05
HBsAg(-)、HBsAb
(-)、HBcAb(-)
(24/12)
HBV-DNA(-)、HBsAg(-)、HBsAb
(-)、HBcAb(-)
(24/12)
HBV-DNA(+)
(25/06)
HBV-DNA(+)、HBsAg(+)、HBsAb
(-)、HBcAb(+)
(25/06)
陰性(輸血前)
陽性(輸血後)
6名の個別NATは
HBV-DNA(-)
【ウイルス相同性確認】
同一採血番号の原料血漿(HBV-DNA検査(10重測定)を実施したところ、10回のうち2回
で陽性となった)と患者検体中のウイルスの塩基配列を検査したところ、両者はPreS/S領
域を含むP領域の前半部1550bpで全て一致、CP/PreC領域624bpでは献血者株において
2塩基の欠失が認められたが、それ以外の配列は全て一致した。
献血者株及び患者株のHBVはGenotype Cであった。
HBeAb(+)
(25/06)
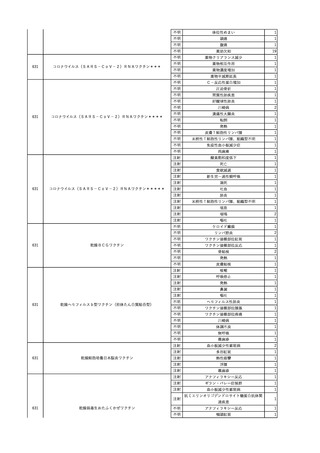
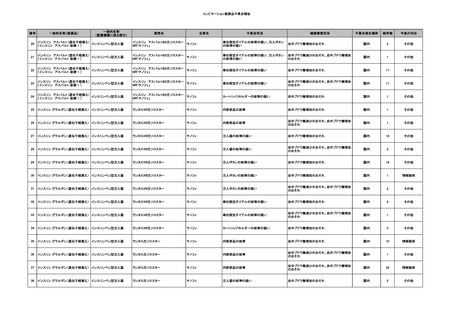
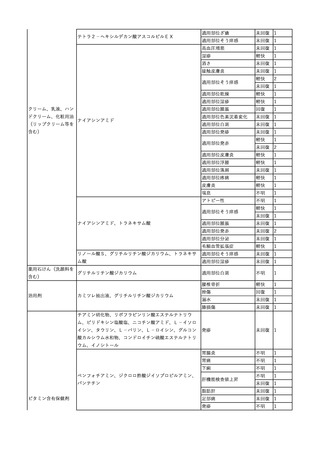
6
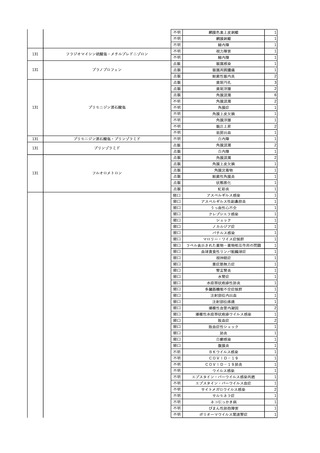
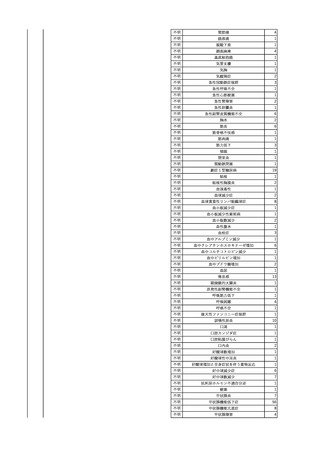
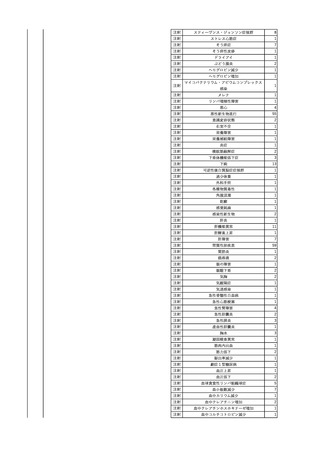
7
8
9
10
照射濃厚血小板-LR(人血
小板濃厚液(放射線照射))
2025/7/1
男
照射赤血球液-LR(人赤血
球液(放射線照射))
0 その他の疾患
照射赤血球液-LR(人赤血
男
球液(放射線照射))
0 その他の疾患
2025/7/1
2025/7/10
2025/7/10
照射赤血球液-LR(人赤血
女
球液(放射線照射))
60
照射赤血球液-LR(人赤血
男
球液(放射線照射))
70 -
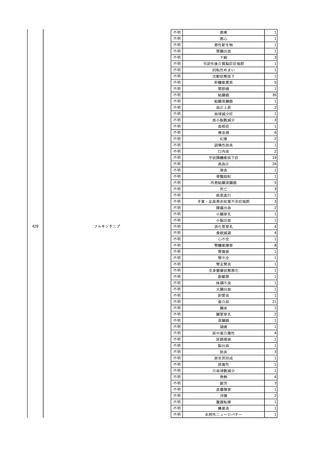
献血ヴェノグロブリンIH(ポリ
エチレングリコール処理人免
2025/4/2 疫グロブリン)
女
赤十字アルブミン(人血清ア
ルブミン)
60
外傷・整形外科的疾患
免疫系疾患
血液腫瘍
血液疾患
CMV-DNA(-)(尿)
(23/01)
サイトメガロウ
イルス感染
23/01-23/02
サイトメガロウ
イルス感染
21/11
C型肝炎
CMV-DNA(+)(尿)
(23/02)
CMV-DNA(-)(尿)
(21/11)
CMV-DNA(+)(尿)
(22/01)
HCV-Ab(-)
(25/02)
HCV-Ab(+)
(25/06)
HCVコア抗原(-)
(25/03)
HCV-RNA(+)
(25/06)
HBsAg(-)
HBV-DNA(+)、HBsAg(+)、HBsAb(-)、HBcAb(+)
(25/07)
25/03
B型肝炎
-
急性B型肝炎
24/12
(ポリエチレン
グリコール処理
人免疫グロブリ
ン)
不明
(検体なし)
(検体なし)
-
7名の保管検体の個別
NATはCMV-DNA(-)
(検体なし)
(検体なし)
-
2名の保管検体の個別
NATはCMV-DNA(-)
HCV-RNA(-)、HCV-Ab(-)
(25/03)
HCV-RNA(+)、HCV-Ab(+)
(25/06)
陰性(輸血前)
陽性(輸血後)
1名の個別NATは
HCV-RNA(-)
調査中
調査中
調査中
調査中
急性B型肝炎と判明し、抗ウイルス薬、ステロイドで治療。
(不明)
-
-
-
-
ウイルス量は減少し、肝障害も改善傾向にある。
(不明)
24/09
(人血清アルブ
ミン)
【HBc抗体及びHBs抗体検査陽性献血者に係る情報】
・同一採血番号
1本の原料血漿を製造、確保済み。
【ポリエチレングリコール処理人免疫グロブリン】
ウイルスの不活化・除去の製造工程として液状加熱処理(60℃、10時間)、8%ポリエチレ
ングリコール処理、ウイルス除去膜処理(平均孔径19nmのウイルス除去膜によるろ過処
理)を施しており、モデルウイルスBVDV(Bovine viral diarrhea virus)を用いたウイルスク
リアランス試験結果でそれぞれ≧4.3、≧4.5、≧7.2というLRVを得ている。
【人血清アルブミン】
ウイルスの不活化・除去の製造工程としてアルコール分画工程、液状加熱処理(60℃、
10時間)を施しており、モデルウイルスBVDV(Bovine viral diarrhea virus)を用いたウイル
スクリアランス試験結果でそれぞれ≧5.3、≧6.8というLRVを得ている。
使用製剤の製造販売業者は不明であることから、自社製品と想定し報告された。
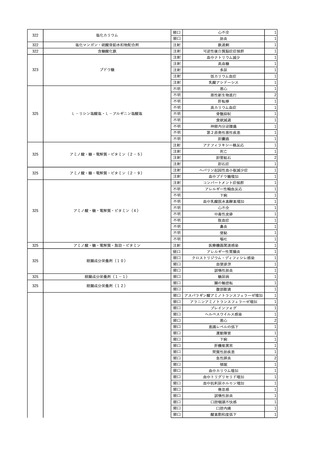
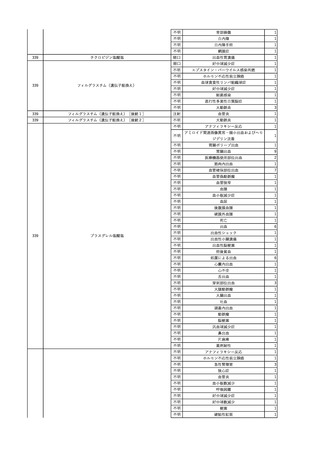
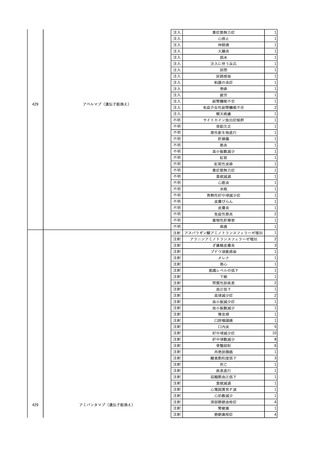
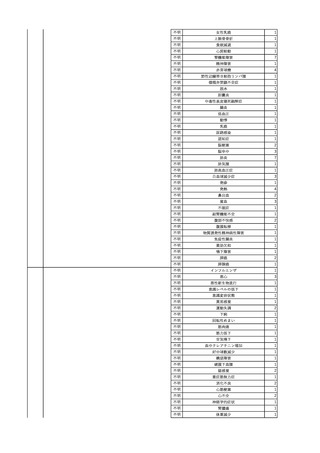
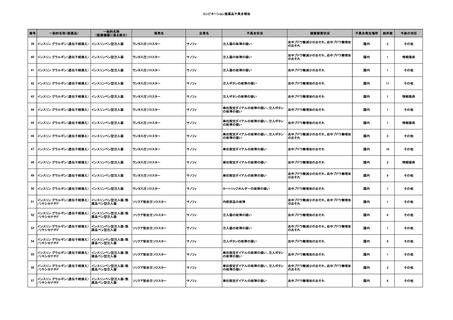
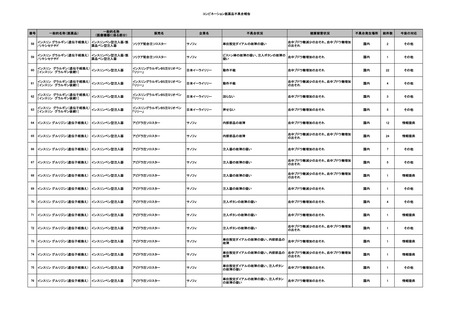
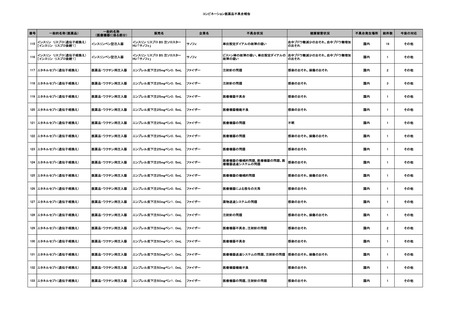
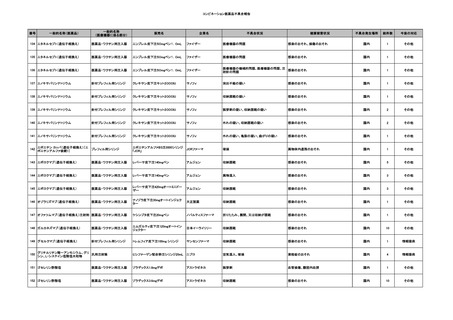
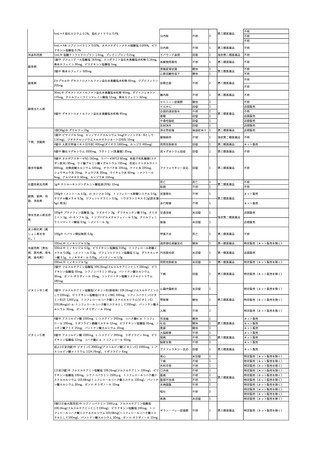
11
献血グロベニン-I(乾燥ポリ
2025/4/21 エチレングリコール処理人免 不明
疫グロブリン)
~10 -
C型肝炎ウイル
不明
ス検査陽性
不明
HCV 陽性。
(不明)
-
512
-
-
-
当該製品は製造工程でエタノール分画、ウイルス除去膜処理、有機溶媒/界面活性剤
処理及び低pHインキュベーション処理によりウイルスの不活化や除去処理が行われてお
り、医薬発第1047号 血漿分画製剤のウイルスに対する安全性確保に関するガイドライ
ン、医薬審第329号 ヒト又は動物細胞株を用いて製造されるバイオテクノロジー応用医薬
品のウイルス安全性評価に従い評価されたウイルスクリアランス指数は9以上であること
を確認している。