よむ、つかう、まなぶ。
総ー4参考3[505KB] (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_63440.html |
| 出典情報 | 中央社会保険医療協議会 総会(第617回 9/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
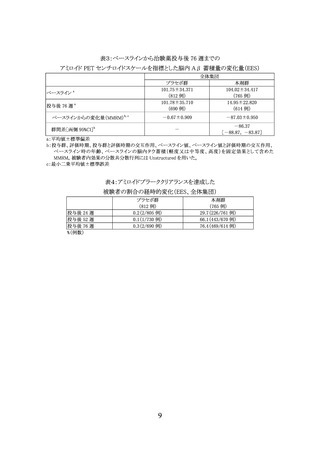
表8:24 週時の有害事象の発現状況(安全性解析対象集団))
全有害事象
主な事象 a
注入に伴う反応
頭痛
アミロイド関連画像異常-浮腫/滲出液貯留
アミロイド関連画像異常-微小出血およびヘモジデリン沈着
転倒
COVID-19
浮動性めまい
尿路感染
関節痛
疲労
下痢
脳表ヘモジデリン沈着症
%(例数)
a:いずれかの群で 5%以上に発現した事象
350 mg 開始群
(212 例)
85.4(181)
700 mg 開始群
(207 例)
84.5(175)
17.0(36)
15.1(32)
13.7(29)
13.2(28)
9.0(19)
9.0(19)
8.0(17)
7.5(16)
6.1(13)
5.7(12)
2.8(6)
2.4(5)
13.5(28)
19.8(41)
23.7(49)
15.9(33)
7.7(16)
4.8(10)
9.2(19)
3.4(7)
3.9(8)
5.3(11)
5.8(12)
5.8(12)
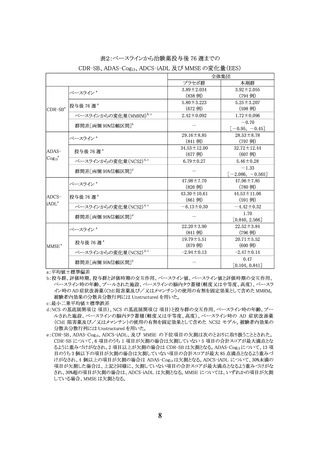
死亡は、350 mg 開始群で 0.5%(1/212 例:脳出血)に認められ、治験薬との因果関係なしと
判断された。重篤な有害事象は、350 mg 開始群で 9.9%(21/212 例)、700 mg 開始群で 8.7%
(18/207 例)に認められた。
治験薬の投与中止に至った有害事象は、350 mg 開始群で 5.2%(11/212 例)、700 mg 開始
群で 3.9%(8/207 例)に認められた。
治験薬との因果関係が否定されない有害事象は、350 mg 開始群で 48.6%(103/212 例)、
700 mg 開始群で 50.2%(104/207 例)に認められた。
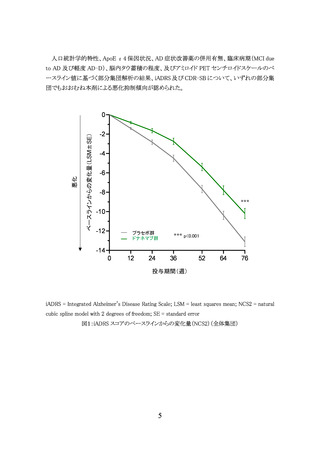
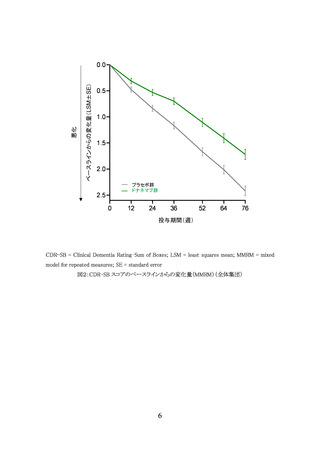
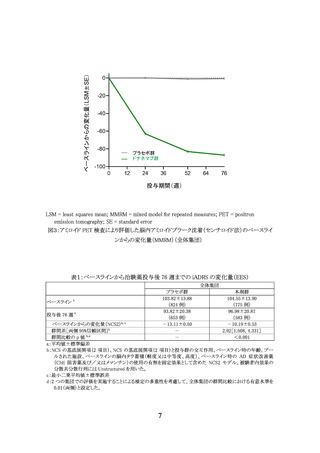
[有効性]
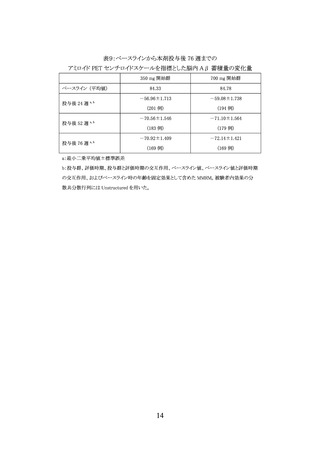
AACQ 試験では臨床的有効性を評価していない。副次評価項目とされたベースラインから
治験薬投与後 76 週までのアミロイド PET 検査(センチロイド法)により評価した脳内 Aβ 蓄積
量の変化量は表9のとおりであり、350 mg 開始群と 700 mg 開始群の間に明らかな違いは認め
られなかった。
13
全有害事象
主な事象 a
注入に伴う反応
頭痛
アミロイド関連画像異常-浮腫/滲出液貯留
アミロイド関連画像異常-微小出血およびヘモジデリン沈着
転倒
COVID-19
浮動性めまい
尿路感染
関節痛
疲労
下痢
脳表ヘモジデリン沈着症
%(例数)
a:いずれかの群で 5%以上に発現した事象
350 mg 開始群
(212 例)
85.4(181)
700 mg 開始群
(207 例)
84.5(175)
17.0(36)
15.1(32)
13.7(29)
13.2(28)
9.0(19)
9.0(19)
8.0(17)
7.5(16)
6.1(13)
5.7(12)
2.8(6)
2.4(5)
13.5(28)
19.8(41)
23.7(49)
15.9(33)
7.7(16)
4.8(10)
9.2(19)
3.4(7)
3.9(8)
5.3(11)
5.8(12)
5.8(12)
死亡は、350 mg 開始群で 0.5%(1/212 例:脳出血)に認められ、治験薬との因果関係なしと
判断された。重篤な有害事象は、350 mg 開始群で 9.9%(21/212 例)、700 mg 開始群で 8.7%
(18/207 例)に認められた。
治験薬の投与中止に至った有害事象は、350 mg 開始群で 5.2%(11/212 例)、700 mg 開始
群で 3.9%(8/207 例)に認められた。
治験薬との因果関係が否定されない有害事象は、350 mg 開始群で 48.6%(103/212 例)、
700 mg 開始群で 50.2%(104/207 例)に認められた。
[有効性]
AACQ 試験では臨床的有効性を評価していない。副次評価項目とされたベースラインから
治験薬投与後 76 週までのアミロイド PET 検査(センチロイド法)により評価した脳内 Aβ 蓄積
量の変化量は表9のとおりであり、350 mg 開始群と 700 mg 開始群の間に明らかな違いは認め
られなかった。
13