よむ、つかう、まなぶ。
(別紙1)先進医療Bの総括報告書に関する評価について[609KB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00108.html |
| 出典情報 | 先進医療会議(第146回 9/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第178回先進医療技術審査部会
別紙1
先進医療B
評価委員
令和7年8月21日
資料2-1
総括報告書に関する評価表(告示旧4)
主担当:
坂井
副担当:
伊藤
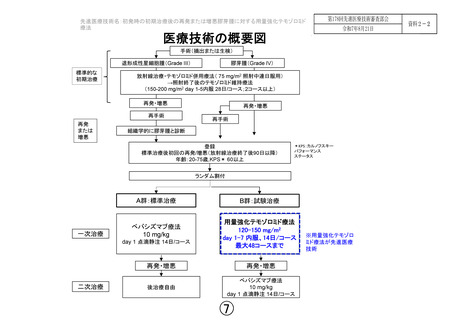
先 進 医 療 テモゾロミド用量強化療法
の名称
申 請 医 療 杏林大学医学部付属病院
機関
医 療 技 術 再発膠芽腫に対しては、近年承認されたベバシズマブを始めとした
の概要
薬物療法などでは治療効果が不十分であり、新たな治療開発が必要
である。
「用量強化テモゾロミド療法」は、初発膠芽腫に対する標準治療薬
であるテモゾロミドを、用量を強化して使用する医療技術である。
欧米からの報告では、再発膠芽腫に対して6か月無増悪生存割合が
10-44%、生存期間中央値が5.4-10.6か月とベバシズマブに匹敵する
治療効果が報告されている。さらに初回再発時、ベバシズマブ療法
の前に用量強化テモゾロミド療法を行うことで、初回再発後の生存
期間の延長が期待できるとする報告もある(生存期間中央値13-15か
月)。
本試験では、再発膠芽腫の予後を改善するため、初回再発および増
悪膠芽腫に対して、用量強化テモゾロミド療法とその再発後のベバ
シズマブ療法の優越性を、標準治療であるベバシズマブ療法とのラ
ンダム化第III相比較試験にて検証する。
○主要評価項目:
有効性評価基準:全生存期間(overall survival:OS)
○副次評価項目:
安全性評価基準:有害事象発生割合、重篤な有害事象発生割合
有効性評価基準:無増悪生存期間(progression-free survival:
PFS)、6 か月無増悪生存割合(6m-PFS)、完全奏効割合(complete
response rate:CR 割合)、奏効割合(response rate:RR)ベバシズ
マブ開始後の PFS、ベバシズマブ開始後の 6m-PFS、ベバシズマブ開始
後の OS、MMSE 非悪化割合、KPS 非悪化割合
1
別紙1
先進医療B
評価委員
令和7年8月21日
資料2-1
総括報告書に関する評価表(告示旧4)
主担当:
坂井
副担当:
伊藤
先 進 医 療 テモゾロミド用量強化療法
の名称
申 請 医 療 杏林大学医学部付属病院
機関
医 療 技 術 再発膠芽腫に対しては、近年承認されたベバシズマブを始めとした
の概要
薬物療法などでは治療効果が不十分であり、新たな治療開発が必要
である。
「用量強化テモゾロミド療法」は、初発膠芽腫に対する標準治療薬
であるテモゾロミドを、用量を強化して使用する医療技術である。
欧米からの報告では、再発膠芽腫に対して6か月無増悪生存割合が
10-44%、生存期間中央値が5.4-10.6か月とベバシズマブに匹敵する
治療効果が報告されている。さらに初回再発時、ベバシズマブ療法
の前に用量強化テモゾロミド療法を行うことで、初回再発後の生存
期間の延長が期待できるとする報告もある(生存期間中央値13-15か
月)。
本試験では、再発膠芽腫の予後を改善するため、初回再発および増
悪膠芽腫に対して、用量強化テモゾロミド療法とその再発後のベバ
シズマブ療法の優越性を、標準治療であるベバシズマブ療法とのラ
ンダム化第III相比較試験にて検証する。
○主要評価項目:
有効性評価基準:全生存期間(overall survival:OS)
○副次評価項目:
安全性評価基準:有害事象発生割合、重篤な有害事象発生割合
有効性評価基準:無増悪生存期間(progression-free survival:
PFS)、6 か月無増悪生存割合(6m-PFS)、完全奏効割合(complete
response rate:CR 割合)、奏効割合(response rate:RR)ベバシズ
マブ開始後の PFS、ベバシズマブ開始後の 6m-PFS、ベバシズマブ開始
後の OS、MMSE 非悪化割合、KPS 非悪化割合
1