よむ、つかう、まなぶ。
薬-1-2参考資料 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_60775.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第237回 8/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
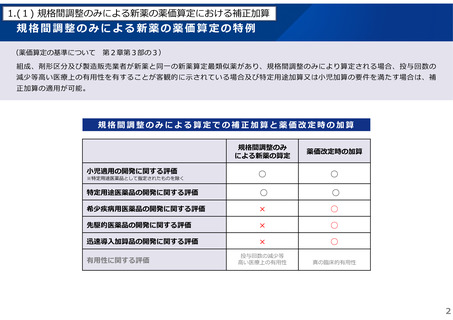
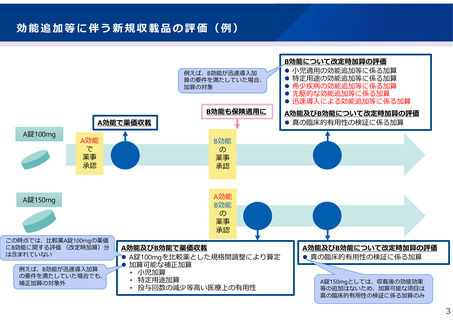
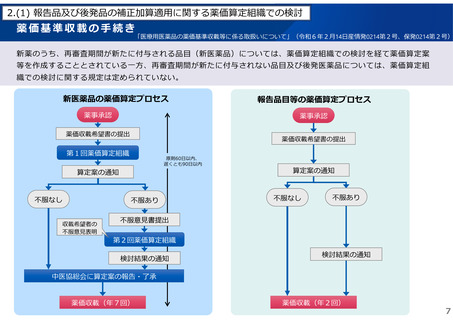
2.(1) 報告品及び後発品の補正加算適用に関する薬価算定組織での検討
薬価基準収載の手続き
「医療⽤医薬品の薬価基準収載等に係る取扱いについて」(令和6年2⽉14日産情発0214第2号、保発0214第2号)
新薬のうち、再審査期間が新たに付与される品目(新医薬品)については、薬価算定組織での検討を経て薬価算定案
等を作成することとされている一方、再審査期間が新たに付与されない品目及び後発医薬品については、薬価算定組
織での検討に関する規定は定められていない。
新医薬品の薬価算定プロセス
薬事承認
薬事承認
薬価収載希望書の提出
薬価収載希望書の提出
第1回薬価算定組織
原則60日以内、
遅くとも90日以内
算定案の通知
不服なし
不服あり
収載希望者の
不服意⾒表明
報告品目等の薬価算定プロセス
算定案の通知
不服なし
不服あり
不服意⾒書提出
第2回薬価算定組織
検討結果の通知
検討結果の通知
中医協総会に算定案の報告・了承
薬価収載(年7回)
薬価収載(年2回)
7
薬価基準収載の手続き
「医療⽤医薬品の薬価基準収載等に係る取扱いについて」(令和6年2⽉14日産情発0214第2号、保発0214第2号)
新薬のうち、再審査期間が新たに付与される品目(新医薬品)については、薬価算定組織での検討を経て薬価算定案
等を作成することとされている一方、再審査期間が新たに付与されない品目及び後発医薬品については、薬価算定組
織での検討に関する規定は定められていない。
新医薬品の薬価算定プロセス
薬事承認
薬事承認
薬価収載希望書の提出
薬価収載希望書の提出
第1回薬価算定組織
原則60日以内、
遅くとも90日以内
算定案の通知
不服なし
不服あり
収載希望者の
不服意⾒表明
報告品目等の薬価算定プロセス
算定案の通知
不服なし
不服あり
不服意⾒書提出
第2回薬価算定組織
検討結果の通知
検討結果の通知
中医協総会に算定案の報告・了承
薬価収載(年7回)
薬価収載(年2回)
7