よむ、つかう、まなぶ。
(別紙3)[4.4MB]先進医療Bに係る新規技術の科学的評価等について (64 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00104.html |
| 出典情報 | 先進医療会議(第142回 4/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
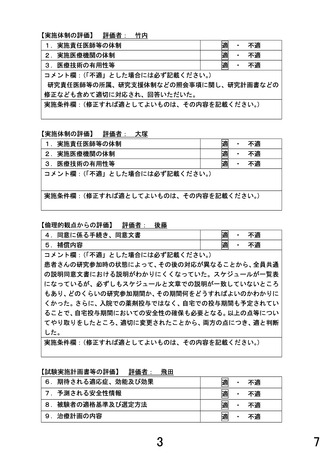
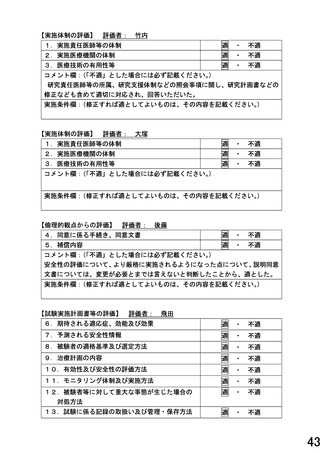
【8章(5)①先進医療継続可否の初期評価 記載修正整備箇所(下線部)】
・・・(略)…
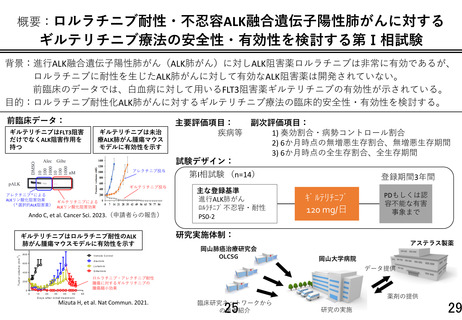
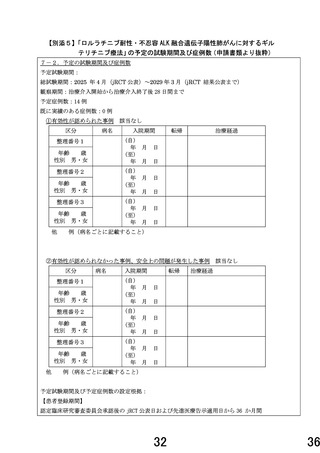
・本研究の対象疾患に対して本被験薬は投与経験がないため、臨床研究中核病院における先進医療
の特例に基づき初期 6 例を登録する。薬物有害反応を伴わずに服用率 80%未満の研究対象者は評価
対象としない。
・・・(略)…
・効果安全性評価委員会が初期安全性評価を行うための評価基準:
1) 被験治療と因果関係のあるグレード 2 以上の薬剤性肺障害
2) 被験治療と因果関係のある 500msec を超える QTc 延長
3) 被験治療中止を要する薬物有害反応(4. 研究の方法 (4) 中止/休薬/減量基準を参照)
4) 4 週間以上の休薬を要する薬物有害反応
5) 減量・休薬基準に該当する薬物有害反応に伴う 30%未満の服薬状況
・・・(略)…
以上
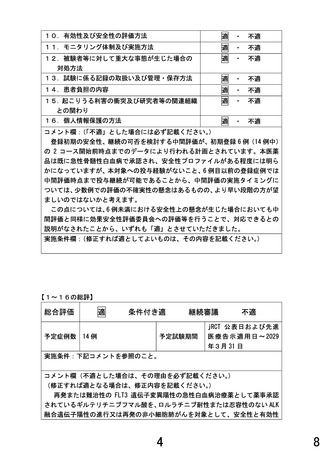
2.本試験終了後に次の試験に移行する際の判断基準について、安全性の評価の観点を含めて教え
て下さい。
【回答】
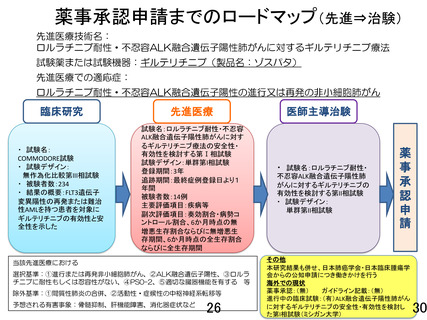
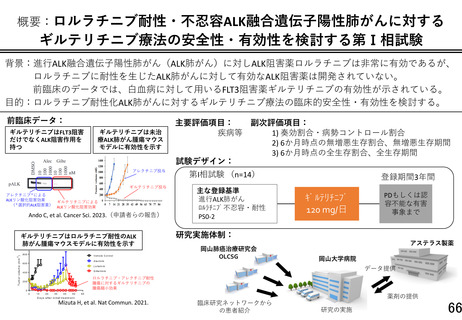
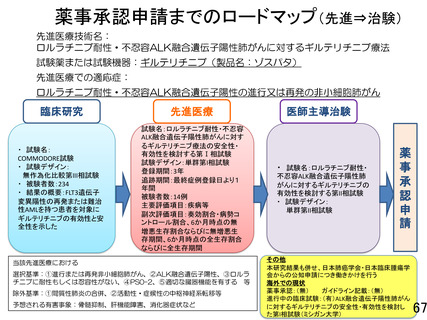
重要なご指摘をありがとうございます。本研究は先進医療 B で実施する特定臨床研究となり、成績次第
では医師主導治験に向けて進めることを念頭に置いております。そのことを踏まえ、研究全体の評価基
準として、研究計画書の『8.データの集計及び統計解析方法』の章に新たに『(6)最終解析結果の解釈』
を設けて本研究の位置づけを明確になるように努めました。
【新たに設けた項(一部、照会事項1.への対応と重複)】
(6)最終解析結果の解釈
最終解析結果は安全性および有効性の観点から以下の様に解釈する。
①安全性の観点
中間評価において、初期安全性評価を行うための評価基準 1)-5)に該当する研究対象者が 6 例中 2 例
以上の場合、研究全体の中止もしくは投与量変更等の勧告・助言を行うことを考慮している。そこで、最
終解析結果の解釈においても評価基準 1)-5)に該当する研究対象者が 14 例中 4 例以下(3 割未満)の
場合、本対象疾患に対する本剤の研究開発は安全性の面から継続可能と解釈する。
②有効性の観点
奏効割合の実現値が 14 例中 5 例(35.7[両側 90%信頼区間:15.3-61.0]%)以上で、実現値が 30%以上
かつ下側信頼限界が無効閾値:10%を超えるとき、本剤の有効性が示唆されたとみなし、本対象疾患に
対する研究開発は有効性の面から継続可能と解釈する。
以上
3
64
・・・(略)…
・本研究の対象疾患に対して本被験薬は投与経験がないため、臨床研究中核病院における先進医療
の特例に基づき初期 6 例を登録する。薬物有害反応を伴わずに服用率 80%未満の研究対象者は評価
対象としない。
・・・(略)…
・効果安全性評価委員会が初期安全性評価を行うための評価基準:
1) 被験治療と因果関係のあるグレード 2 以上の薬剤性肺障害
2) 被験治療と因果関係のある 500msec を超える QTc 延長
3) 被験治療中止を要する薬物有害反応(4. 研究の方法 (4) 中止/休薬/減量基準を参照)
4) 4 週間以上の休薬を要する薬物有害反応
5) 減量・休薬基準に該当する薬物有害反応に伴う 30%未満の服薬状況
・・・(略)…
以上
2.本試験終了後に次の試験に移行する際の判断基準について、安全性の評価の観点を含めて教え
て下さい。
【回答】
重要なご指摘をありがとうございます。本研究は先進医療 B で実施する特定臨床研究となり、成績次第
では医師主導治験に向けて進めることを念頭に置いております。そのことを踏まえ、研究全体の評価基
準として、研究計画書の『8.データの集計及び統計解析方法』の章に新たに『(6)最終解析結果の解釈』
を設けて本研究の位置づけを明確になるように努めました。
【新たに設けた項(一部、照会事項1.への対応と重複)】
(6)最終解析結果の解釈
最終解析結果は安全性および有効性の観点から以下の様に解釈する。
①安全性の観点
中間評価において、初期安全性評価を行うための評価基準 1)-5)に該当する研究対象者が 6 例中 2 例
以上の場合、研究全体の中止もしくは投与量変更等の勧告・助言を行うことを考慮している。そこで、最
終解析結果の解釈においても評価基準 1)-5)に該当する研究対象者が 14 例中 4 例以下(3 割未満)の
場合、本対象疾患に対する本剤の研究開発は安全性の面から継続可能と解釈する。
②有効性の観点
奏効割合の実現値が 14 例中 5 例(35.7[両側 90%信頼区間:15.3-61.0]%)以上で、実現値が 30%以上
かつ下側信頼限界が無効閾値:10%を超えるとき、本剤の有効性が示唆されたとみなし、本対象疾患に
対する研究開発は有効性の面から継続可能と解釈する。
以上
3
64