よむ、つかう、まなぶ。
(別紙3)[4.4MB]先進医療Bに係る新規技術の科学的評価等について (63 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00104.html |
| 出典情報 | 先進医療会議(第142回 4/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
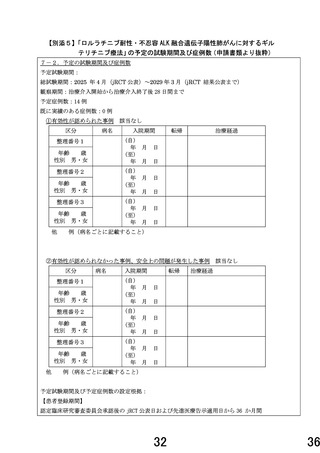
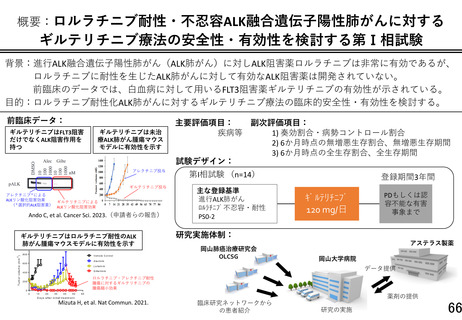
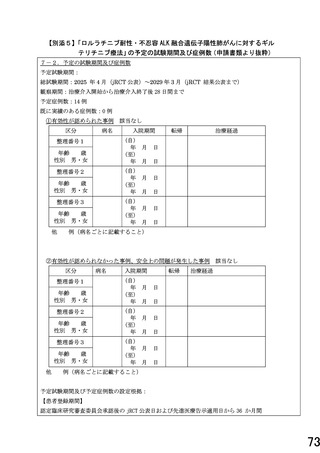
終解析結果の解釈においても評価基準 1)-5)に該当する研究対象者が 14 例中 4 例以下(3 割未満)の
場合、本対象疾患に対する本剤の研究開発は安全性の面から継続可能と解釈する。
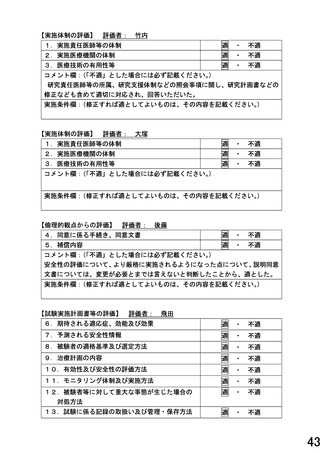
また、研究計画書 10 頁の『初期安全性評価を行うための評価基準』に関して、ご指摘いただいた 5 点
については以下のように考え、対応致します。
1) 評価可能例の服用率:
薬物有害反応を伴わない研究対象者については、服用率 80%以上を評価対象とします。この旨が明
確になるよう、研究計画書の『8(5) ①先進医療継続可否の初期評価』に『薬物有害反応を伴わず
に服用率 80%未満の研究対象者は評価対象としない。』を追記致します。
2) 毒性で服用率未達の研究対象者の取扱い:
毒性により薬物有害反応が発現した研究対象者については初期評価の対象に含めます。また、薬
物有害反応に伴う服薬不良な研究対象者の初期評価における取り扱いは新たに下記の評価基準
5)として追加規定します。
3) QTc 延長の測定方法:
研究対象者の安全性確保を第一に考え、延長がみられた時には速やかに適正な医療対応がとれ
るよう、実施施設でバリデートされており、日常的に用いている ECG 測定器の機械値を用います。
4) 薬剤性肺障害:
忍容性を再考のうえ、下記のようにグレード 2 以上を忍容不可対象とすべく記載を修正致します。こ
れに伴い、研究計画書『4(4) ②介入内容』の『中止/休薬/減量基準』における薬剤性肺障害による
中止基準も『すべてのグレード』から『グレード 2 以上』に修正致します。
5) 「…疾病等」の表記の適切性:
初期安全性評価の際には『薬物有害反応』(被験薬との因果関係がある有害事象;ADR)を用いるこ
ととし、下記のとおり評価基準の記載を修正致します。
なお、本研究は臨床研究法の下で実施することから、安全性情報の収集範囲は『疾病等』のまま
としていますが、その評価に関わる定義として、研究計画書 25 章の冒頭部分に『疾病等、有害事象』
の定義に加えて、『薬物有害反応』の定義を以下の様に追記のうえ記載整備致します。
【25章 記載修正整備箇所(下線部、なお波線部分は記載順入替のみ)】
(1)有害事象、疾病等、および薬物有害事象の定義
有害事象とは、研究参加者に発現したあらゆる好ましくない症状および徴候(臨床検査値の異常を含
む)と定義し、被験治療との因果関係を問わない。
疾病等とは、特定臨床研究の実施に起因するものと疑われる疾病や障害、死亡、感染症、臨床検査
値の異常、諸症状などをいう。
薬物有害反応とは、投与量に関わらず医薬品に対する有害で意図しない反応、すなわち、有害事象
のうち医薬品との因果関係を否定できないものをいう。
・・・(略)…
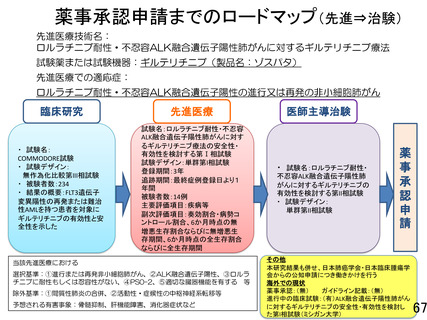
そのうえで、研究計画書8章(5)の『①先進医療継続可否の初期評価」の項を以下のように改訂し、効
果安全性評価委員会が初期安全性評価を行うための評価基準を明確化致します。
2
63
場合、本対象疾患に対する本剤の研究開発は安全性の面から継続可能と解釈する。
また、研究計画書 10 頁の『初期安全性評価を行うための評価基準』に関して、ご指摘いただいた 5 点
については以下のように考え、対応致します。
1) 評価可能例の服用率:
薬物有害反応を伴わない研究対象者については、服用率 80%以上を評価対象とします。この旨が明
確になるよう、研究計画書の『8(5) ①先進医療継続可否の初期評価』に『薬物有害反応を伴わず
に服用率 80%未満の研究対象者は評価対象としない。』を追記致します。
2) 毒性で服用率未達の研究対象者の取扱い:
毒性により薬物有害反応が発現した研究対象者については初期評価の対象に含めます。また、薬
物有害反応に伴う服薬不良な研究対象者の初期評価における取り扱いは新たに下記の評価基準
5)として追加規定します。
3) QTc 延長の測定方法:
研究対象者の安全性確保を第一に考え、延長がみられた時には速やかに適正な医療対応がとれ
るよう、実施施設でバリデートされており、日常的に用いている ECG 測定器の機械値を用います。
4) 薬剤性肺障害:
忍容性を再考のうえ、下記のようにグレード 2 以上を忍容不可対象とすべく記載を修正致します。こ
れに伴い、研究計画書『4(4) ②介入内容』の『中止/休薬/減量基準』における薬剤性肺障害による
中止基準も『すべてのグレード』から『グレード 2 以上』に修正致します。
5) 「…疾病等」の表記の適切性:
初期安全性評価の際には『薬物有害反応』(被験薬との因果関係がある有害事象;ADR)を用いるこ
ととし、下記のとおり評価基準の記載を修正致します。
なお、本研究は臨床研究法の下で実施することから、安全性情報の収集範囲は『疾病等』のまま
としていますが、その評価に関わる定義として、研究計画書 25 章の冒頭部分に『疾病等、有害事象』
の定義に加えて、『薬物有害反応』の定義を以下の様に追記のうえ記載整備致します。
【25章 記載修正整備箇所(下線部、なお波線部分は記載順入替のみ)】
(1)有害事象、疾病等、および薬物有害事象の定義
有害事象とは、研究参加者に発現したあらゆる好ましくない症状および徴候(臨床検査値の異常を含
む)と定義し、被験治療との因果関係を問わない。
疾病等とは、特定臨床研究の実施に起因するものと疑われる疾病や障害、死亡、感染症、臨床検査
値の異常、諸症状などをいう。
薬物有害反応とは、投与量に関わらず医薬品に対する有害で意図しない反応、すなわち、有害事象
のうち医薬品との因果関係を否定できないものをいう。
・・・(略)…
そのうえで、研究計画書8章(5)の『①先進医療継続可否の初期評価」の項を以下のように改訂し、効
果安全性評価委員会が初期安全性評価を行うための評価基準を明確化致します。
2
63