よむ、つかう、まなぶ。
(別紙3)[4.4MB]先進医療Bに係る新規技術の科学的評価等について (44 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00104.html |
| 出典情報 | 先進医療会議(第142回 4/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
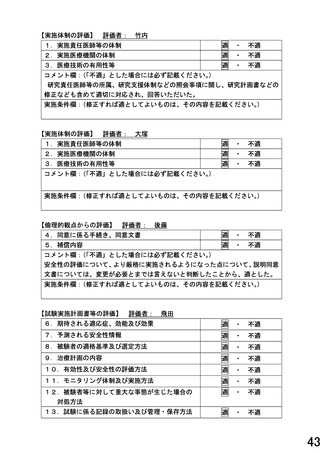
14.患者負担の内容
適
・
不適
15.起こりうる利害の衝突及び研究者等の関連組織
との関わり
適
・
不適
16.個人情報保護の方法
適
・
不適
コメント欄:(「不適」とした場合には必ず記載ください。)
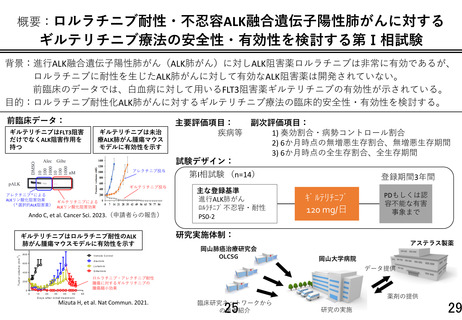
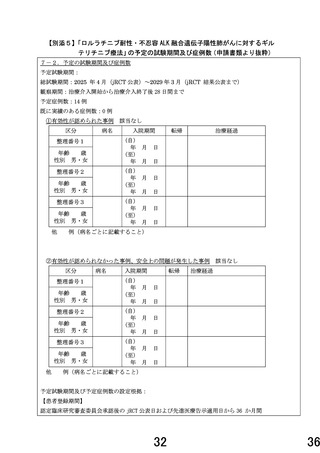
本研究は、急性白血病で既承認のギルテリチニブのドラッグリポジショニング
として、ALK 肺がん患者 14 名を対象とした非盲検、単群、既承認の用法・用量を
用いて、主に安全性を評価する第Ⅰ相試験が計画されています。
登録初期の安全性、継続の可否を検討する中間評価を初期登録 6 例(14 例中)
の 2 コース開始前時点までのデータにより行われますが、その際の安全性評価に
おける評価方法、判断基準について、より明確化されています。また、次相への移
行規準についても、安全性及び有効性の観点から規準を明確化されましたことか
ら、いずれも「適」とさせていただきました。
実施条件欄:(修正すれば適としてよいものは、その内容を記載ください。)
【1~16の総評】
総合評価
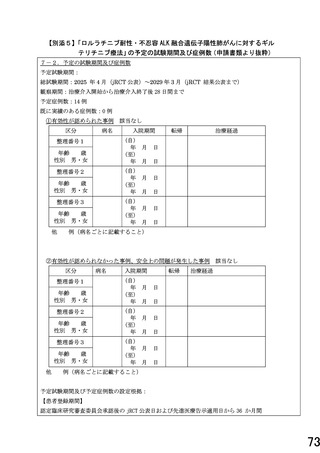
予定症例数 14 例
適
条件付き適
継続審議
予定試験期間
不適
jRCT 公表日および先進
医 療 告 示 適 用 日 ~ 2029
年3月 31 日
実施条件:下記コメントを参照のこと。
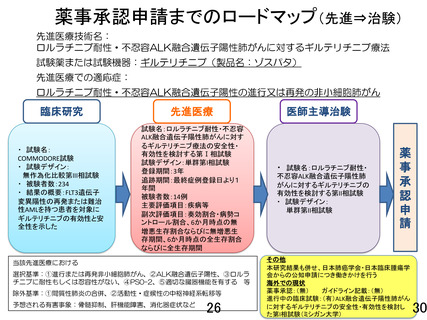
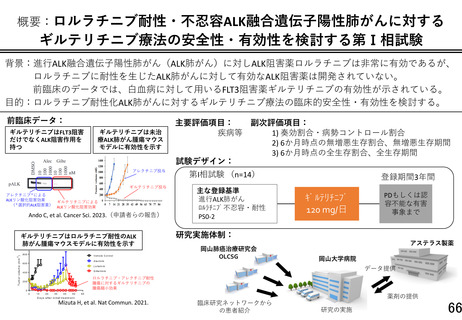
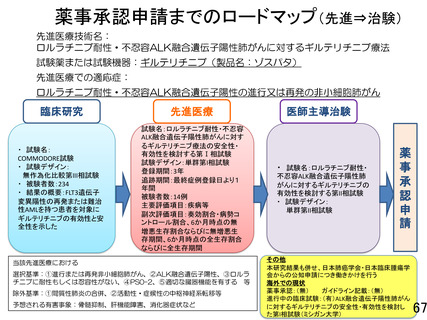
再発または難治性の FLT3 遺伝子変異陽性の急性白血病治療薬として薬事承認され
ているギルテリチニブフマル酸を、ロルラチニブ耐性または忍容性のない ALK 融
合遺伝子陽性の進行又は再発の非小細胞肺がんを対象として、安全性と有効性を
検討する第1相試験である。実施体制、研究デザイン、中間評価、患者説明文書な
どに関して照会を行い、研究計画書や患者同意文書の修正を含め、多岐にわたる項
目に丁寧に回答された。さらに、エンドポイント設定に関する疑義照会に対して、
より具体的な数値目標を設定し、研究計画書を修正ただいた。アンメットニーズの
高い本対象疾患において、我が国で初めてとなるギルテリチニブ療法の安全性・有
効性を検討するもので、貴重な情報となることが期待される。
コメント欄(不適とした場合は、その理由を必ず記載ください。)
(修正すれば適となる場合は、修正内容を記載ください。)
44
適
・
不適
15.起こりうる利害の衝突及び研究者等の関連組織
との関わり
適
・
不適
16.個人情報保護の方法
適
・
不適
コメント欄:(「不適」とした場合には必ず記載ください。)
本研究は、急性白血病で既承認のギルテリチニブのドラッグリポジショニング
として、ALK 肺がん患者 14 名を対象とした非盲検、単群、既承認の用法・用量を
用いて、主に安全性を評価する第Ⅰ相試験が計画されています。
登録初期の安全性、継続の可否を検討する中間評価を初期登録 6 例(14 例中)
の 2 コース開始前時点までのデータにより行われますが、その際の安全性評価に
おける評価方法、判断基準について、より明確化されています。また、次相への移
行規準についても、安全性及び有効性の観点から規準を明確化されましたことか
ら、いずれも「適」とさせていただきました。
実施条件欄:(修正すれば適としてよいものは、その内容を記載ください。)
【1~16の総評】
総合評価
予定症例数 14 例
適
条件付き適
継続審議
予定試験期間
不適
jRCT 公表日および先進
医 療 告 示 適 用 日 ~ 2029
年3月 31 日
実施条件:下記コメントを参照のこと。
再発または難治性の FLT3 遺伝子変異陽性の急性白血病治療薬として薬事承認され
ているギルテリチニブフマル酸を、ロルラチニブ耐性または忍容性のない ALK 融
合遺伝子陽性の進行又は再発の非小細胞肺がんを対象として、安全性と有効性を
検討する第1相試験である。実施体制、研究デザイン、中間評価、患者説明文書な
どに関して照会を行い、研究計画書や患者同意文書の修正を含め、多岐にわたる項
目に丁寧に回答された。さらに、エンドポイント設定に関する疑義照会に対して、
より具体的な数値目標を設定し、研究計画書を修正ただいた。アンメットニーズの
高い本対象疾患において、我が国で初めてとなるギルテリチニブ療法の安全性・有
効性を検討するもので、貴重な情報となることが期待される。
コメント欄(不適とした場合は、その理由を必ず記載ください。)
(修正すれば適となる場合は、修正内容を記載ください。)
44