よむ、つかう、まなぶ。
資料 先-3○通知等の改正について(報告) (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00069.html |
| 出典情報 | 先進医療会議(第131回 4/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
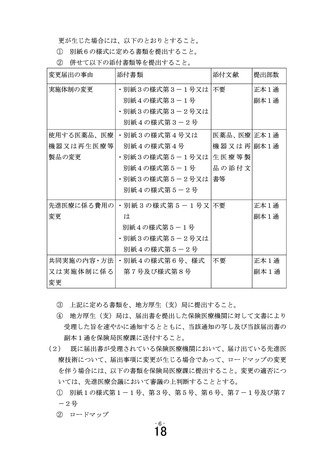
既に届出書が受理されている保険医療機関において、届け
既に届出書が受理されている保険医療機関において、届け
出ている先進医療技術について届出事項に変更が生じた場合
出ている先進医療技術について届出事項に変更が生じた場合
には、別紙6の様式第1号(添付書類を含む。
)に定める書
には、別紙6の様式第1号(添付書類を含む。)に定める書
類を、医政局研究開発政策課に電磁的記録媒体により提出す
類を、医政局研究開発振興課に電磁的記録媒体により提出す
ること(医政局研究開発政策課から指示があった場合には、
ること(医政局研究開発振興課から指示があった場合には、
加えて、書面にて正本1通を郵送すること)
。
加えて、書面にて正本1通を郵送すること)
。
なお、再生医療等安全性確保法が適用される研究を実施す
なお、再生医療等安全性確保法が適用される研究を実施す
る場合であって、再生医療等提供計画の変更を行う場合は、
る場合であって、再生医療等提供計画の変更を行う場合は、
認定再生医療等委員会で「適」とされた変更後の再生医療等
認定再生医療等委員会で「適」とされた変更後の再生医療等
提供計画を提出すること。また、再生医療等安全性確保法に
提供計画を提出すること。また、再生医療等安全性確保法に
基づく厚生労働大臣への再生医療等提供計画の提出及び情報
基づく厚生労働大臣への再生医療等提供計画の提出及び情報
の公表は、部会で「適」とされた後(部会で修正があった場
の公表は、部会で「適」とされた後(部会で修正があった場
合には、その修正について再度認定再生医療等委員会の意見
合には、その修正について再度認定再生医療等委員会の意見
を聴き「適」とされた後)に行うこと。
を聴き「適」とされた後)に行うこと。
また、臨床研究法に規定する臨床研究を実施する場合であ
また、臨床研究法に規定する臨床研究を実施する場合であ
って、実施計画の変更を行う場合は、認定臨床研究審査委員
って、実施計画の変更を行う場合は、認定臨床研究審査委員
会で「承認」とされた変更後の実施計画を提出すること。ま
会で「承認」とされた変更後の実施計画を提出すること。ま
た、臨床研究法に基づく厚生労働大臣への実施計画の提出及
た、臨床研究法に基づく厚生労働大臣への実施計画の提出及
び情報の公表は、部会で「適」とされた後(部会で修正があ
び情報の公表は、部会で「適」とされた後(部会で修正があ
った場合には、その修正について再度認定臨床研究審査委員
った場合には、その修正について再度認定臨床研究審査委員
会の意見を聴き「承認」とされた後)に行うこと。
会の意見を聴き「承認」とされた後)に行うこと。
5 「医療上の必要性の高い未承認薬・適応外薬検討会議」にお
5
いて医療上の必要性が高いとされた抗がん剤等を用いる先進医
「医療上の必要性の高い未承認薬・適応外薬検討会議」にお
いて医療上の必要性が高いとされた抗がん剤等を用いる先進医
7
既に届出書が受理されている保険医療機関において、届け
出ている先進医療技術について届出事項に変更が生じた場合
出ている先進医療技術について届出事項に変更が生じた場合
には、別紙6の様式第1号(添付書類を含む。
)に定める書
には、別紙6の様式第1号(添付書類を含む。)に定める書
類を、医政局研究開発政策課に電磁的記録媒体により提出す
類を、医政局研究開発振興課に電磁的記録媒体により提出す
ること(医政局研究開発政策課から指示があった場合には、
ること(医政局研究開発振興課から指示があった場合には、
加えて、書面にて正本1通を郵送すること)
。
加えて、書面にて正本1通を郵送すること)
。
なお、再生医療等安全性確保法が適用される研究を実施す
なお、再生医療等安全性確保法が適用される研究を実施す
る場合であって、再生医療等提供計画の変更を行う場合は、
る場合であって、再生医療等提供計画の変更を行う場合は、
認定再生医療等委員会で「適」とされた変更後の再生医療等
認定再生医療等委員会で「適」とされた変更後の再生医療等
提供計画を提出すること。また、再生医療等安全性確保法に
提供計画を提出すること。また、再生医療等安全性確保法に
基づく厚生労働大臣への再生医療等提供計画の提出及び情報
基づく厚生労働大臣への再生医療等提供計画の提出及び情報
の公表は、部会で「適」とされた後(部会で修正があった場
の公表は、部会で「適」とされた後(部会で修正があった場
合には、その修正について再度認定再生医療等委員会の意見
合には、その修正について再度認定再生医療等委員会の意見
を聴き「適」とされた後)に行うこと。
を聴き「適」とされた後)に行うこと。
また、臨床研究法に規定する臨床研究を実施する場合であ
また、臨床研究法に規定する臨床研究を実施する場合であ
って、実施計画の変更を行う場合は、認定臨床研究審査委員
って、実施計画の変更を行う場合は、認定臨床研究審査委員
会で「承認」とされた変更後の実施計画を提出すること。ま
会で「承認」とされた変更後の実施計画を提出すること。ま
た、臨床研究法に基づく厚生労働大臣への実施計画の提出及
た、臨床研究法に基づく厚生労働大臣への実施計画の提出及
び情報の公表は、部会で「適」とされた後(部会で修正があ
び情報の公表は、部会で「適」とされた後(部会で修正があ
った場合には、その修正について再度認定臨床研究審査委員
った場合には、その修正について再度認定臨床研究審査委員
会の意見を聴き「承認」とされた後)に行うこと。
会の意見を聴き「承認」とされた後)に行うこと。
5 「医療上の必要性の高い未承認薬・適応外薬検討会議」にお
5
いて医療上の必要性が高いとされた抗がん剤等を用いる先進医
「医療上の必要性の高い未承認薬・適応外薬検討会議」にお
いて医療上の必要性が高いとされた抗がん剤等を用いる先進医
7