よむ、つかう、まなぶ。
資料 先-3○通知等の改正について(報告) (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00069.html |
| 出典情報 | 先進医療会議(第131回 4/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
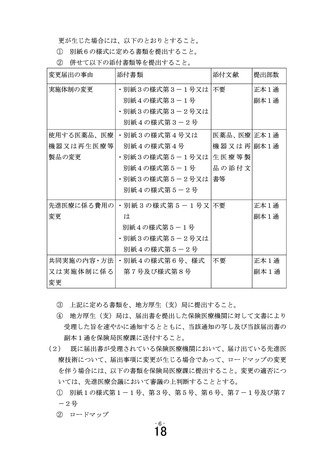
8条の8第1項に規定する利益相反管理基準及び同条第3項に規定する利
益相反管理計画(再生医療等安全性確保法が適用される研究の場合に限る。)
(※3)
エ
臨床研究法第5条第1項に規定する実施計画並びに臨床研究法施行規則
(平成 30 年厚生労働省令第 17 号)第 21 条第1項に規定する利益相反管理
基準及び同条第3項に規定する利益相反管理計画(臨床研究法に規定する
臨床研究の場合に限る。)(※4)
オ
同意・説明文書
カ
医療技術の概要図(1枚程度)
キ
薬事承認又は保険収載までのロードマップ
ク
症例報告書(CRF)
ケ
医薬品、医療機器又は再生医療等製品の概要書
※1
監査(実施する場合)及びモニタリングの標準業務手順書
※2
統計解析計画書
※3
再生医療等提供計画については、認定再生医療等委員会で「適」とさ
れたものを提出すること。なお、再生医療等安全性確保法に基づく厚生
労働大臣への再生医療等提供計画の提出及び情報の公表は、先進医療技
術審査部会(以下「部会」という。)及び先進医療会議で「適」とされた後
(部会又は先進医療会議で修正があった場合には、その修正について再
度認定再生医療等委員会の意見を聴き「適」とされた後)に行うこと。
※4
実施計画については、認定臨床研究審査委員会で「承認」とされたも
のを提出すること。なお、臨床研究法に基づく厚生労働大臣への実施計
画の提出及び情報の公表は、部会及び先進医療会議で「適」とされた後
(部会又は先進医療会議で修正があった場合には、その修正について再
度認定臨床研究審査委員会の意見を聴き「承認」とされた後)に行うこ
と。
(2)
届出書提出後の手続
地方厚生(支)局は、提出された新規技術に係る科学的評価の結果、実施が
認められた医療技術である場合には、当該新規技術が先進医療告示に規定され
た日に先進医療実施届出書を受理したものとし、届出書を提出した保険医療機
関に対して文書により受理した旨を速やかに通知するとともに、当該通知の写
しを保険局医療課に送付すること。なお、再生医療等安全性確保法又は臨床研
究法が適用される研究の場合には、厚生労働省が整備するデータベース(jRCT)
の登録 ID 番号が付与された後、当該登録 ID 番号を医政局研究開発政策課に報
告すること。
-8-
20
益相反管理計画(再生医療等安全性確保法が適用される研究の場合に限る。)
(※3)
エ
臨床研究法第5条第1項に規定する実施計画並びに臨床研究法施行規則
(平成 30 年厚生労働省令第 17 号)第 21 条第1項に規定する利益相反管理
基準及び同条第3項に規定する利益相反管理計画(臨床研究法に規定する
臨床研究の場合に限る。)(※4)
オ
同意・説明文書
カ
医療技術の概要図(1枚程度)
キ
薬事承認又は保険収載までのロードマップ
ク
症例報告書(CRF)
ケ
医薬品、医療機器又は再生医療等製品の概要書
※1
監査(実施する場合)及びモニタリングの標準業務手順書
※2
統計解析計画書
※3
再生医療等提供計画については、認定再生医療等委員会で「適」とさ
れたものを提出すること。なお、再生医療等安全性確保法に基づく厚生
労働大臣への再生医療等提供計画の提出及び情報の公表は、先進医療技
術審査部会(以下「部会」という。)及び先進医療会議で「適」とされた後
(部会又は先進医療会議で修正があった場合には、その修正について再
度認定再生医療等委員会の意見を聴き「適」とされた後)に行うこと。
※4
実施計画については、認定臨床研究審査委員会で「承認」とされたも
のを提出すること。なお、臨床研究法に基づく厚生労働大臣への実施計
画の提出及び情報の公表は、部会及び先進医療会議で「適」とされた後
(部会又は先進医療会議で修正があった場合には、その修正について再
度認定臨床研究審査委員会の意見を聴き「承認」とされた後)に行うこ
と。
(2)
届出書提出後の手続
地方厚生(支)局は、提出された新規技術に係る科学的評価の結果、実施が
認められた医療技術である場合には、当該新規技術が先進医療告示に規定され
た日に先進医療実施届出書を受理したものとし、届出書を提出した保険医療機
関に対して文書により受理した旨を速やかに通知するとともに、当該通知の写
しを保険局医療課に送付すること。なお、再生医療等安全性確保法又は臨床研
究法が適用される研究の場合には、厚生労働省が整備するデータベース(jRCT)
の登録 ID 番号が付与された後、当該登録 ID 番号を医政局研究開発政策課に報
告すること。
-8-
20