よむ、つかう、まなぶ。
資料2-7-3 E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告に関するQ&A の改正について[1.2MB] (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
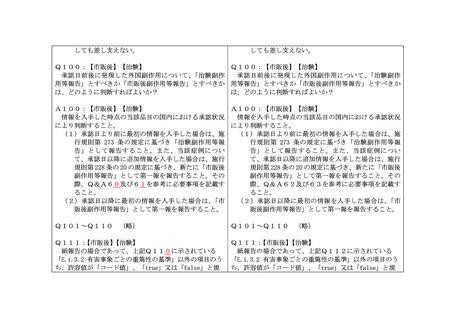
Q67:【市販後】【治験】
死亡原因とならなかった副作用の転帰について、「E.i.7 最終観察時の副作用/有
害事象の転帰」はどのように記載すればよいか?
A67:【市販後】【治験】
副作用ごとに「死亡」以外の適切な転帰を選択すればよい。
Q68:【市販後】【治験】
「E.i.7 最終観察時の副作用/有害事象の転帰」において、母親が流産した場合は、
胎児に関する転帰又は母親に関する転帰のどちらを記載すべきか?
A68:【市販後】【治験】
胎児死亡又は早期自然流産の症例の場合には、副作用名(胎児死亡等)に対する親の
転帰を記載すること。例えば、親の体調が回復した場合は「1=回復」でよい。
Q69:【市販後】【治験】
「E.i.8 医療専門家による医学的確認」は、
「C.2.r.4 資格」が「1=医師」
、
「2=薬剤師」
、
「3=その他の医療専門家」の場合は記載不要と考えてよいか?
A69:
【市販後】
【治験】
よい。C.2.r.4 が「4=弁護士」又は「5=消費者又はその他の非医療専門家」の場合に E.i.8
に医学的確認の有無を記載すること。
Q70:
【市販後】【治験】
薬剤誘発性リンパ球刺激試験(DLST)の結果を記載する場合、「F.r.2.2b 検査名
(MedDRA コード)」に DLST の MedDRA LLT コードを記載することができるが、DLST
に使用した薬剤名はどの項目に記載すればよいか?
A70:
【市販後】【治験】
「F.r.2.2b 検査名(MedDRA コード)」に DLST を示す MedDRA LLT コードを記載し、
「F.r.3.4 検査結果に関する非構造化データ」に薬剤名及び検査結果を記載すること。
Q71:
【市販後】【治験】
「G.k.4.r.7 バッチ/ロット番号」は他社被疑薬も記載する必要があるか?
A71:
【市販後】
他社被疑薬がワクチンである場合は、そのバッチ/ロット番号の情報入手に努め、可
能な限り記載すること。
【治験】
被疑薬のうちその他の医薬品がワクチンである場合は、そのバッチ/ロット番号の情
報入手に努め、可能な限り記載すること。
Q72:【市販後】
-23-
死亡原因とならなかった副作用の転帰について、「E.i.7 最終観察時の副作用/有
害事象の転帰」はどのように記載すればよいか?
A67:【市販後】【治験】
副作用ごとに「死亡」以外の適切な転帰を選択すればよい。
Q68:【市販後】【治験】
「E.i.7 最終観察時の副作用/有害事象の転帰」において、母親が流産した場合は、
胎児に関する転帰又は母親に関する転帰のどちらを記載すべきか?
A68:【市販後】【治験】
胎児死亡又は早期自然流産の症例の場合には、副作用名(胎児死亡等)に対する親の
転帰を記載すること。例えば、親の体調が回復した場合は「1=回復」でよい。
Q69:【市販後】【治験】
「E.i.8 医療専門家による医学的確認」は、
「C.2.r.4 資格」が「1=医師」
、
「2=薬剤師」
、
「3=その他の医療専門家」の場合は記載不要と考えてよいか?
A69:
【市販後】
【治験】
よい。C.2.r.4 が「4=弁護士」又は「5=消費者又はその他の非医療専門家」の場合に E.i.8
に医学的確認の有無を記載すること。
Q70:
【市販後】【治験】
薬剤誘発性リンパ球刺激試験(DLST)の結果を記載する場合、「F.r.2.2b 検査名
(MedDRA コード)」に DLST の MedDRA LLT コードを記載することができるが、DLST
に使用した薬剤名はどの項目に記載すればよいか?
A70:
【市販後】【治験】
「F.r.2.2b 検査名(MedDRA コード)」に DLST を示す MedDRA LLT コードを記載し、
「F.r.3.4 検査結果に関する非構造化データ」に薬剤名及び検査結果を記載すること。
Q71:
【市販後】【治験】
「G.k.4.r.7 バッチ/ロット番号」は他社被疑薬も記載する必要があるか?
A71:
【市販後】
他社被疑薬がワクチンである場合は、そのバッチ/ロット番号の情報入手に努め、可
能な限り記載すること。
【治験】
被疑薬のうちその他の医薬品がワクチンである場合は、そのバッチ/ロット番号の情
報入手に努め、可能な限り記載すること。
Q72:【市販後】
-23-