よむ、つかう、まなぶ。
資料2-7-3 E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告に関するQ&A の改正について[1.2MB] (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
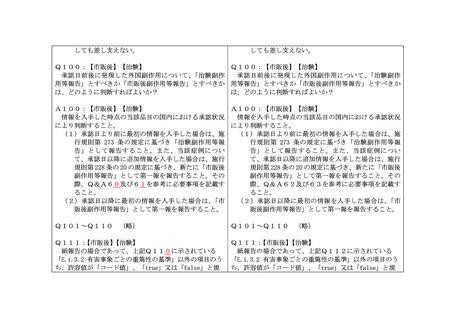
Q44:
【市販後】
【治験】
入力種別の「NUM」及び「日付(最低精度)
」において、全角文字の使用は許容される
のか?
A44:
【市販後】
【治験】
入力種別の「NUM」及び「日付(最低精度)」については半角文字で記載すること。
Q45:
【市販後】
【治験】
入力種別の「TXT」において、ウムラウト付文字等の使用は許容されるのか?
A45:
【市販後】
【治験】
UTF-8 で使用可能な文字列であれば、ウムラウト付文字等も受付可能とする。ただ
し、国内症例においてはウムラウト付文字等は使用しないことが望ましい。また、XML
メッセージ上認められていない「<」や「>」のような文字種は使用できない。
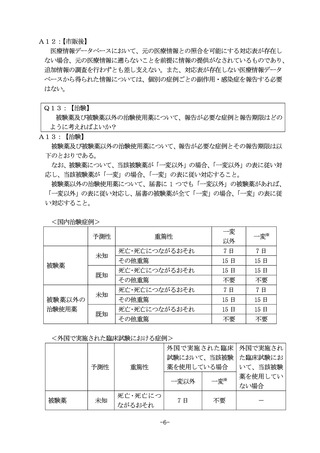
(6)J 項目
Q46:
【市販後】
【治験】
市販後副作用等報告において、30 日以内の報告の対象であると考えていたところ、
第一報を報告する前に追加情報により 15 日以内の報告の対象であることが判明し、
30 日以内の報告と 15 日以内の報告の内容を合わせて一度に報告する場合、「J2.2.1
報告起算日」はどちらの起算日を記載すればよいか?また、「C.1.7 本症例は当該国
の緊急報告の基準を満たすか?」は 15 日報告とすべきか?
また、治験副作用等報告において、15 日以内の報告の対象であると考えていたとこ
ろ、第一報を報告する前に追加情報により7日以内の報告の対象であることが判明し、
15 日以内の報告と7日以内の報告の内容を合わせて一度に報告する場合、
「J2.2.1 報
告起算日」はどちらの起算日を記載すればよいか?また、
「C.1.7 本症例は当該国の緊
急報告の基準を満たすか?」は7日報告とすべきか?
A46:
【市販後】
「J2.2.1 報告起算日」は 30 日以内の報告の対象である情報を入手した日とし、
「J2.2.2 報告起算日に関するコメント」で、報告起算日及び追加情報入手日と報告期
限日の関係を説明すること。また、
「C.1.7 本症例は当該国の緊急報告の基準を満たす
か?」は 15 日報告とすること。
【治験】
「J2.2.1 報告起算日」は 15 日以内の報告の対象である情報を入手した日とし、
「J2.2.2 報告起算日に関するコメント」で、報告起算日及び追加情報入手日と報告期
限日の関係を説明とすること。また、
「C.1.7 本症例は当該国の緊急報告の基準を満た
すか?」は7日報告とすること。
-17-
【市販後】
【治験】
入力種別の「NUM」及び「日付(最低精度)
」において、全角文字の使用は許容される
のか?
A44:
【市販後】
【治験】
入力種別の「NUM」及び「日付(最低精度)」については半角文字で記載すること。
Q45:
【市販後】
【治験】
入力種別の「TXT」において、ウムラウト付文字等の使用は許容されるのか?
A45:
【市販後】
【治験】
UTF-8 で使用可能な文字列であれば、ウムラウト付文字等も受付可能とする。ただ
し、国内症例においてはウムラウト付文字等は使用しないことが望ましい。また、XML
メッセージ上認められていない「<」や「>」のような文字種は使用できない。
(6)J 項目
Q46:
【市販後】
【治験】
市販後副作用等報告において、30 日以内の報告の対象であると考えていたところ、
第一報を報告する前に追加情報により 15 日以内の報告の対象であることが判明し、
30 日以内の報告と 15 日以内の報告の内容を合わせて一度に報告する場合、「J2.2.1
報告起算日」はどちらの起算日を記載すればよいか?また、「C.1.7 本症例は当該国
の緊急報告の基準を満たすか?」は 15 日報告とすべきか?
また、治験副作用等報告において、15 日以内の報告の対象であると考えていたとこ
ろ、第一報を報告する前に追加情報により7日以内の報告の対象であることが判明し、
15 日以内の報告と7日以内の報告の内容を合わせて一度に報告する場合、
「J2.2.1 報
告起算日」はどちらの起算日を記載すればよいか?また、
「C.1.7 本症例は当該国の緊
急報告の基準を満たすか?」は7日報告とすべきか?
A46:
【市販後】
「J2.2.1 報告起算日」は 30 日以内の報告の対象である情報を入手した日とし、
「J2.2.2 報告起算日に関するコメント」で、報告起算日及び追加情報入手日と報告期
限日の関係を説明すること。また、
「C.1.7 本症例は当該国の緊急報告の基準を満たす
か?」は 15 日報告とすること。
【治験】
「J2.2.1 報告起算日」は 15 日以内の報告の対象である情報を入手した日とし、
「J2.2.2 報告起算日に関するコメント」で、報告起算日及び追加情報入手日と報告期
限日の関係を説明とすること。また、
「C.1.7 本症例は当該国の緊急報告の基準を満た
すか?」は7日報告とすること。
-17-