よむ、つかう、まなぶ。
資料2-7-3 E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告に関するQ&A の改正について[1.2MB] (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
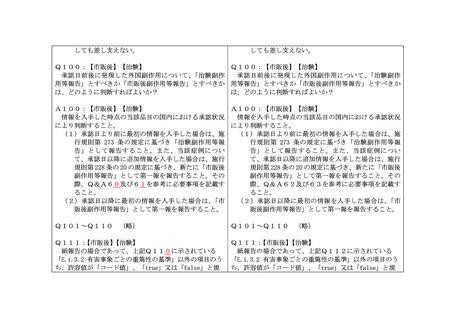
Q9:【市販後】【治験】
医薬品又は治験使用薬によると考えられる奇形等の発現があり中絶した場合、親-
子/胎児報告として報告するのか?
A9:【市販後】【治験】
親-子/胎児報告として報告すること。
Q10:【治験】
治験前より予定していた療法又は検査を治験中に実施することのみを目的とした入
院(予定手術や検査等)の場合は、報告対象から除外してよいか?
A10:【治験】
除外してよい。
Q11:
【市販後】
医師から次のような報告があった場合、感染症報告は必要か?
①血液製剤によるウイルス肝炎
②無顆粒球症に伴う敗血症
③抗生物質の使用の結果起きる菌交代症
④ワクチン投与に伴う無菌性髄膜炎
⑤抗生物質使用中の MRSA(メチシリン耐性ブドウ球菌)感染
⑥医薬品等の使用中に起きた新興感染症
A11:
【市販後】
(1)①については、感染症報告が必要である。
(2)②~④については、従前から副作用として報告を求めており、今後も同様に報告
すること。
(3)⑤については、症例報告として報告する必要はないが、抗生物質の使用に伴う当
該抗生物質への耐性菌に関し、その耐性メカニズムや出現傾向の変化等に係る知見
については、研究報告として扱うべきかどうか、PMDA 医薬品安全対策第一部又は医
薬品安全対策第二部に個別に相談すること。
(4)⑥については、感染症報告が必要である。国内症例であるか外国症例であるかに
かかわらず患者の症状等の詳細情報について調査するとともに、診断根拠を明確に
すること。
また、当該事例が起きた場合は、PMDA 医薬品安全対策第一部又は医薬品安全対策第二
部(体外診断用医薬品の場合は、医療機器品質管理・安全対策部医療機器安全課)に個
別に相談すること。
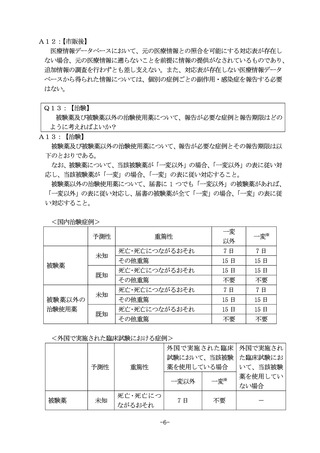
Q12:
【市販後】
MID-NET 等の医療情報データベースを用いた調査で有害事象の発現を知ったが、対
応表が存在せず、元の医療情報に遡ることができない。この場合において、副作用等
報告・感染症報告を行う必要があるか?
-5-
医薬品又は治験使用薬によると考えられる奇形等の発現があり中絶した場合、親-
子/胎児報告として報告するのか?
A9:【市販後】【治験】
親-子/胎児報告として報告すること。
Q10:【治験】
治験前より予定していた療法又は検査を治験中に実施することのみを目的とした入
院(予定手術や検査等)の場合は、報告対象から除外してよいか?
A10:【治験】
除外してよい。
Q11:
【市販後】
医師から次のような報告があった場合、感染症報告は必要か?
①血液製剤によるウイルス肝炎
②無顆粒球症に伴う敗血症
③抗生物質の使用の結果起きる菌交代症
④ワクチン投与に伴う無菌性髄膜炎
⑤抗生物質使用中の MRSA(メチシリン耐性ブドウ球菌)感染
⑥医薬品等の使用中に起きた新興感染症
A11:
【市販後】
(1)①については、感染症報告が必要である。
(2)②~④については、従前から副作用として報告を求めており、今後も同様に報告
すること。
(3)⑤については、症例報告として報告する必要はないが、抗生物質の使用に伴う当
該抗生物質への耐性菌に関し、その耐性メカニズムや出現傾向の変化等に係る知見
については、研究報告として扱うべきかどうか、PMDA 医薬品安全対策第一部又は医
薬品安全対策第二部に個別に相談すること。
(4)⑥については、感染症報告が必要である。国内症例であるか外国症例であるかに
かかわらず患者の症状等の詳細情報について調査するとともに、診断根拠を明確に
すること。
また、当該事例が起きた場合は、PMDA 医薬品安全対策第一部又は医薬品安全対策第二
部(体外診断用医薬品の場合は、医療機器品質管理・安全対策部医療機器安全課)に個
別に相談すること。
Q12:
【市販後】
MID-NET 等の医療情報データベースを用いた調査で有害事象の発現を知ったが、対
応表が存在せず、元の医療情報に遡ることができない。この場合において、副作用等
報告・感染症報告を行う必要があるか?
-5-