よむ、つかう、まなぶ。
資料2-7-3 E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告に関するQ&A の改正について[1.2MB] (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
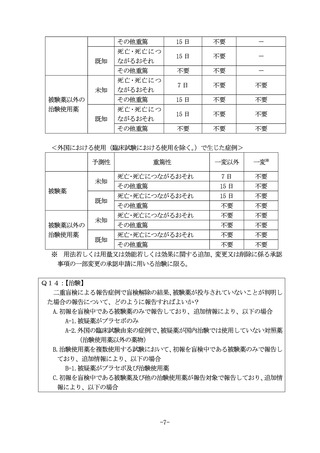
C-1.開鍵した結果がプラセボ又は外国の臨床試験由来の症例における対照薬で
あって国内治験では使用していない薬物(治験使用薬以外の薬物)で、被疑薬とし
ていた他の治験使用薬が報告対象のまま残る場合
C-2. 開鍵した結果がプラセボ又は外国の臨床試験由来の症例における対照薬で
あって国内治験では使用していない薬物(治験使用薬以外の薬物)で、被疑薬とし
ていた他の治験使用薬が報告対象ではなくなる場合
A14:
【治験】
A-1.報告対象の治験使用薬が投与されていないため、取下げ報告を行う。
A-2.治験使用薬が投与されていないため、取下げ報告を行う。
(被疑薬である対照薬は国
内治験では使用していない対照薬〈治験使用薬以外の薬物〉であるため、報告対象で
はない)
B-1.被験薬は投与されていないが、被疑薬として報告対象の治験使用薬が残るため、追
加報告を行う
C-1.被験薬は投与されていないが、被疑薬として報告対象の治験使用薬が残るため、追
加報告を行う
C-2.被験薬は投与されていないが、報告対象の治験使用薬が投与されているため、報告
対象外として追加報告を行う。
Q15:
【治験】
当該症例は存在しているが、治験責任医師から一旦報告された有害事象が再考等によ
り、削除された結果、報告対象の有害事象がなくなった場合の報告はどのようにすれば
よいか?
A15:
【治験】
当該事象そのものが存在しなかった場合は、
「症例そのものが存在しなかった場合」と
同様に取下げ報告を行うこと。ただし、当該事象以外に報告対象の有害事象が存在する
場合(報告対象であった有害事象の因果関係が否定された場合や重篤性などが変更され
た場合を含む)はこの限りではない。
Q16:
【治験】
外国で実施された臨床試験における症例において、被験薬との因果関係は否定され報
告対象外であっても、被験薬以外の治験使用薬が被疑薬となる場合、報告対象となる
か?
A16:
【治験】
情報を入手した症例については、報告対象となる。
Q17:
【市販後】
【治験】
治験を製造販売後臨床試験に切り替えて継続実施する場合、治験中に治験使用薬と
して使用されていた薬物(製造販売後臨床試験では、製造販売後臨床試験使用薬)に
-8-
あって国内治験では使用していない薬物(治験使用薬以外の薬物)で、被疑薬とし
ていた他の治験使用薬が報告対象のまま残る場合
C-2. 開鍵した結果がプラセボ又は外国の臨床試験由来の症例における対照薬で
あって国内治験では使用していない薬物(治験使用薬以外の薬物)で、被疑薬とし
ていた他の治験使用薬が報告対象ではなくなる場合
A14:
【治験】
A-1.報告対象の治験使用薬が投与されていないため、取下げ報告を行う。
A-2.治験使用薬が投与されていないため、取下げ報告を行う。
(被疑薬である対照薬は国
内治験では使用していない対照薬〈治験使用薬以外の薬物〉であるため、報告対象で
はない)
B-1.被験薬は投与されていないが、被疑薬として報告対象の治験使用薬が残るため、追
加報告を行う
C-1.被験薬は投与されていないが、被疑薬として報告対象の治験使用薬が残るため、追
加報告を行う
C-2.被験薬は投与されていないが、報告対象の治験使用薬が投与されているため、報告
対象外として追加報告を行う。
Q15:
【治験】
当該症例は存在しているが、治験責任医師から一旦報告された有害事象が再考等によ
り、削除された結果、報告対象の有害事象がなくなった場合の報告はどのようにすれば
よいか?
A15:
【治験】
当該事象そのものが存在しなかった場合は、
「症例そのものが存在しなかった場合」と
同様に取下げ報告を行うこと。ただし、当該事象以外に報告対象の有害事象が存在する
場合(報告対象であった有害事象の因果関係が否定された場合や重篤性などが変更され
た場合を含む)はこの限りではない。
Q16:
【治験】
外国で実施された臨床試験における症例において、被験薬との因果関係は否定され報
告対象外であっても、被験薬以外の治験使用薬が被疑薬となる場合、報告対象となる
か?
A16:
【治験】
情報を入手した症例については、報告対象となる。
Q17:
【市販後】
【治験】
治験を製造販売後臨床試験に切り替えて継続実施する場合、治験中に治験使用薬と
して使用されていた薬物(製造販売後臨床試験では、製造販売後臨床試験使用薬)に
-8-