よむ、つかう、まなぶ。
資料2-7-3 E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告に関するQ&A の改正について[1.2MB] (29 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
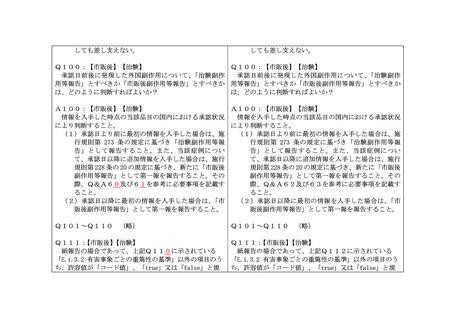
Q58:【市販後】
製造販売業者が製造販売後安全管理業務を一部委託している場合、製造販売業者が
委託先より情報を入手した日を「C.1.4 情報源から最初に報告が入手された日」として
よいか?
A58:【市販後】
製造販売業者又は委託先のいずれかが、最初に情報を入手した日を「C.1.4」として取
り扱うこと。
Q59:【治験】
治験国内管理人が治験使用薬に関する副作用等の報告を行う場合、「C.1.4 情報源か
ら最初に報告が入手された日」は、どの時点とすべきか?
A59:
【治験】
本邦内に住所を有しない治験の依頼をした者(以下「外国治験依頼者」という。)又
は治験国内管理人のいずれかが、先に当該情報を入手した時点とすること。
Q60:【市販後】【治験】
「治験副作用等報告」で報告した症例と同一の症例を「市販後副作用等報告」とし
て報告する場合、「C.1.8.1 世界的に固有の症例識別子」及び「C.1.10.r 本報告と
関連する報告の識別子」には、各々の報告における識別子を必ず記載する必要がある
か?
A60:【市販後】【治験】
「C.1.8.1」は「市販後副作用等報告」と「治験副作用等報告」で同一の識別子とし、
また、可能であれば「C.1.10.r」に各々の報告における識別子を記載すること。さらに、
「J2.11 その他参考事項等」には、
「治験副作用等報告」
(又は「市販後副作用等報告」)
において既に提出済である旨又は提出予定である旨を記載し、既に提出済である場合に
は、当該報告の「J2.1 識別番号」も記載すること。
Q61:【市販後】【治験】
「治験副作用等報告」で報告した症例と同一の症例を「市販後副作用等報告」とし
て報告する場合、企業固有の症例報告番号等(「C.1.1 送信者ごとに固有の(症例)
安全性報告識別子」、「N.2.r.1 メッセージ識別子」)は、「治験副作用等報告」と
して報告する場合と「市販後副作用等報告」として報告する場合とで同じ値を用いる
べきか、又は異なる値を用いるべきか?
A61:【市販後】【治験】
異なる値を用いること。
Q62:【市販後】【治験】
患者略名の一部が不明・未記載又は全部未記載の場合、「D.1 患者(名前又はイニ
シャル)」は「X.X.」と記載しても差し支えないか?
A62:【市販後】【治験】
-21-
製造販売業者が製造販売後安全管理業務を一部委託している場合、製造販売業者が
委託先より情報を入手した日を「C.1.4 情報源から最初に報告が入手された日」として
よいか?
A58:【市販後】
製造販売業者又は委託先のいずれかが、最初に情報を入手した日を「C.1.4」として取
り扱うこと。
Q59:【治験】
治験国内管理人が治験使用薬に関する副作用等の報告を行う場合、「C.1.4 情報源か
ら最初に報告が入手された日」は、どの時点とすべきか?
A59:
【治験】
本邦内に住所を有しない治験の依頼をした者(以下「外国治験依頼者」という。)又
は治験国内管理人のいずれかが、先に当該情報を入手した時点とすること。
Q60:【市販後】【治験】
「治験副作用等報告」で報告した症例と同一の症例を「市販後副作用等報告」とし
て報告する場合、「C.1.8.1 世界的に固有の症例識別子」及び「C.1.10.r 本報告と
関連する報告の識別子」には、各々の報告における識別子を必ず記載する必要がある
か?
A60:【市販後】【治験】
「C.1.8.1」は「市販後副作用等報告」と「治験副作用等報告」で同一の識別子とし、
また、可能であれば「C.1.10.r」に各々の報告における識別子を記載すること。さらに、
「J2.11 その他参考事項等」には、
「治験副作用等報告」
(又は「市販後副作用等報告」)
において既に提出済である旨又は提出予定である旨を記載し、既に提出済である場合に
は、当該報告の「J2.1 識別番号」も記載すること。
Q61:【市販後】【治験】
「治験副作用等報告」で報告した症例と同一の症例を「市販後副作用等報告」とし
て報告する場合、企業固有の症例報告番号等(「C.1.1 送信者ごとに固有の(症例)
安全性報告識別子」、「N.2.r.1 メッセージ識別子」)は、「治験副作用等報告」と
して報告する場合と「市販後副作用等報告」として報告する場合とで同じ値を用いる
べきか、又は異なる値を用いるべきか?
A61:【市販後】【治験】
異なる値を用いること。
Q62:【市販後】【治験】
患者略名の一部が不明・未記載又は全部未記載の場合、「D.1 患者(名前又はイニ
シャル)」は「X.X.」と記載しても差し支えないか?
A62:【市販後】【治験】
-21-