よむ、つかう、まなぶ。
別紙1○先進医療Bの総括報告書に関する評価について(告示番号旧51/ UMIN000042408) (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00052.html |
| 出典情報 | 先進医療会議(第116回 11/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
副担当: 伊藤構成員
有効性
A.従来の医療技術を用いるよりも、大幅に有効であ
る。
B.従来の医療技術を用いるよりも、やや有効である。
C.従来の医療技術を用いるのと、同程度である。
D.従来の医療技術を用いるよりも、劣る。
E.その他
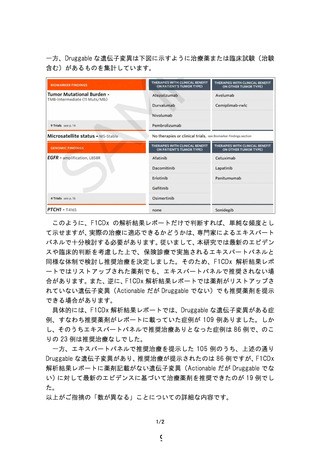
コメント欄: F1CDx の臨床的有用性を検証するためには、(1) F1CDx の結果に基
いて標準治療とは異なる推奨治療が実施され、(2)推奨治療によって全生存時間の
延長が観測される必要があると考えられます。しかし問題点として、(1)では、た
とえ推奨されたとしても治験や臨床試験が行われていないなど治療できないこと
があること、(2)では、推奨治療といってもそのエビデンスにはバラツキがあるこ
とが挙げられます。そこで本研究では、主要評価項目として、Actionable な遺伝
子変異ありの割合を設定しており、F1CDx によって推奨治療を検討するために必要
な情報が得られるかどうかを検討しています。しかし、この指標は臨床的有用性に
直結しておらず、むしろ副次評価項目に設定された「エキスパートパネルによる推
奨治療が提示できる症例の割合」の方が臨床的有用性としては適切だと思われま
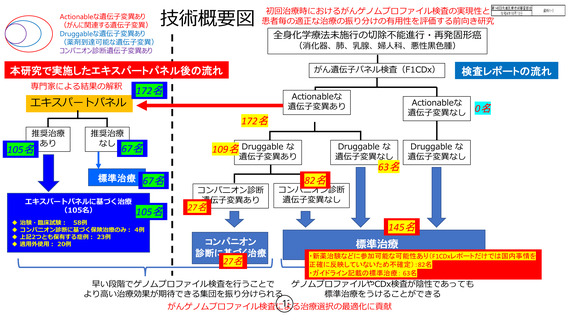
す。「エキスパートパネルによる推奨治療が提示できる症例の割合」は、172 名中
105 名で、その内訳は、治験・臨床試験:58 例、コンパニオン診断に基づく保険治
療のみ:4 例、上記 2 つとも保有する症例:23 例、適用外使用:20 例となってお
り、
「コンパニオン診断に基づく保険治療のみ」であった 4 例以外は、治療の選択
肢が増えたと言えます。ただ、推奨された治療が必ずしも実施されるわけではない
こと、また、標準治療と比較して推奨治療の方が全生存時間を必ずしも延ばすわけ
ではないことを鑑みると、本研究のデータをもって、F1CDx の臨床的有用性が「検
証」されたと判断することは難しいと考えます。
安全性
A.問題なし。(ほとんど副作用、合併症なし)
B.あまり問題なし。(軽い副作用、合併症あり)
C.問題あり。(重い副作用、合併症が発生することあ
り)
D.その他
コメント欄: 体外診断薬であるので、安全性に問題はありません。
5
有効性
A.従来の医療技術を用いるよりも、大幅に有効であ
る。
B.従来の医療技術を用いるよりも、やや有効である。
C.従来の医療技術を用いるのと、同程度である。
D.従来の医療技術を用いるよりも、劣る。
E.その他
コメント欄: F1CDx の臨床的有用性を検証するためには、(1) F1CDx の結果に基
いて標準治療とは異なる推奨治療が実施され、(2)推奨治療によって全生存時間の
延長が観測される必要があると考えられます。しかし問題点として、(1)では、た
とえ推奨されたとしても治験や臨床試験が行われていないなど治療できないこと
があること、(2)では、推奨治療といってもそのエビデンスにはバラツキがあるこ
とが挙げられます。そこで本研究では、主要評価項目として、Actionable な遺伝
子変異ありの割合を設定しており、F1CDx によって推奨治療を検討するために必要
な情報が得られるかどうかを検討しています。しかし、この指標は臨床的有用性に
直結しておらず、むしろ副次評価項目に設定された「エキスパートパネルによる推
奨治療が提示できる症例の割合」の方が臨床的有用性としては適切だと思われま
す。「エキスパートパネルによる推奨治療が提示できる症例の割合」は、172 名中
105 名で、その内訳は、治験・臨床試験:58 例、コンパニオン診断に基づく保険治
療のみ:4 例、上記 2 つとも保有する症例:23 例、適用外使用:20 例となってお
り、
「コンパニオン診断に基づく保険治療のみ」であった 4 例以外は、治療の選択
肢が増えたと言えます。ただ、推奨された治療が必ずしも実施されるわけではない
こと、また、標準治療と比較して推奨治療の方が全生存時間を必ずしも延ばすわけ
ではないことを鑑みると、本研究のデータをもって、F1CDx の臨床的有用性が「検
証」されたと判断することは難しいと考えます。
安全性
A.問題なし。(ほとんど副作用、合併症なし)
B.あまり問題なし。(軽い副作用、合併症あり)
C.問題あり。(重い副作用、合併症が発生することあ
り)
D.その他
コメント欄: 体外診断薬であるので、安全性に問題はありません。
5