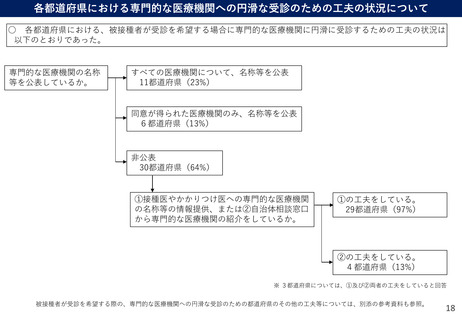
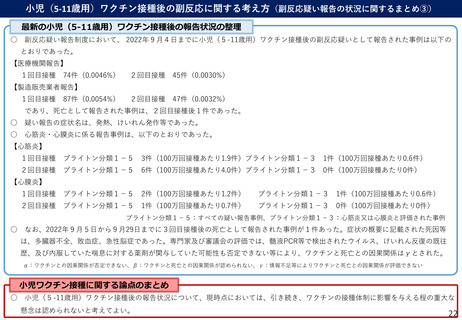
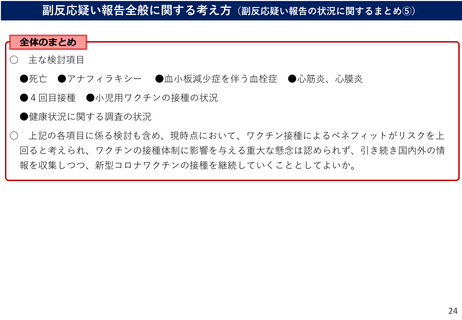
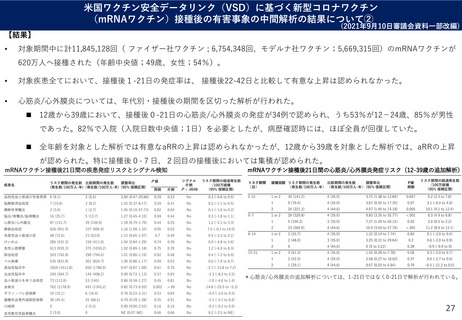
よむ、つかう、まなぶ。
資料1-8 副反応疑い報告の状況について【審議会意見反映版】 (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00052.html |
| 出典情報 | 第85回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第14回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(10/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
<参考>5~11歳の小児におけるファイザー社ワクチンの3回目接種の安全性
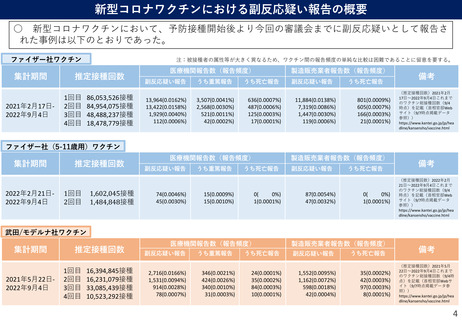
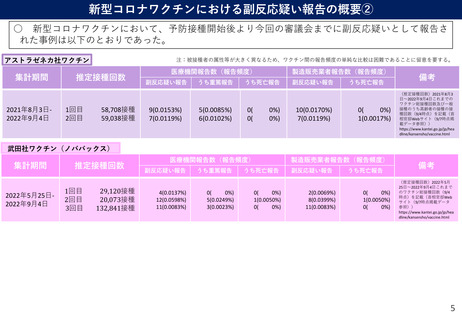
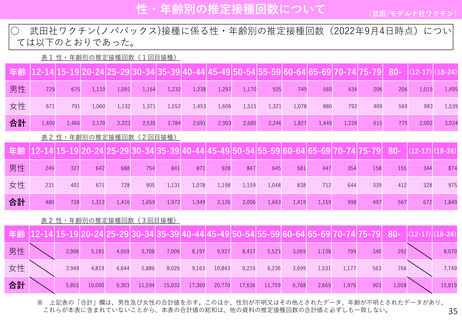
○ 米国においてファイザー社ワクチンの3回目接種を受けた5ー11歳の小児のうち、v-safeに報告さ
れた局所・全身反応と健康への影響、及びVAERSに報告された有害事象を解析。
○ ファイザー社ワクチンの2回目、3回目接種後の局所反応の出現頻度はそれぞれ68.0%、68.5%、全
身反応はそれぞれ45.8%、45.6%であり、いずれも有意差はみられなかった。
Safety Monitoring of Pfizer-BioNTech COVID-19 Vaccine Booster Doses Among Children Aged 5–11 Years — United
States, May 17–July 31, 2022.(MMWR Morb Mortal Wkly Rep August 19, 2022;71:1047–1051)
表
研究方法:米国において2022年5月17日から7月31日の期間にファイザー社ワク
チンの3回目接種を受けた5ー11歳の小児のうち、予防接種後サーベイランスシ
ステム(v-safe※1)登録者、及びワクチン有害事象報告システム(VAERS ※2)へ
の報告者が対象。v-safeに報告された局所・全身反応と健康への影響※3、及び
VAERSに報告された有害事象を解析した観察研究。
5-11歳の小児におけるファイザー社ワクチン
の1~3回目接種後にv-safeに報告された局所・
全身反応と健康への影響
結果:
v-safeの登録者のうち、1~3回目接種の全てをファイザー社ワクチンで実施し
た3,249名が解析された。接種後1週間において報告された局所・全身反応の頻度
は、2回目接種後と3回目接種後で比較して以下のとおりであり、有意差はみら
れなかった。
・局所反応
2回目接種後:68.0%
3回目接種後:68.5%
・全身反応
2回目接種後:45.8%
3回目接種後:45.6%
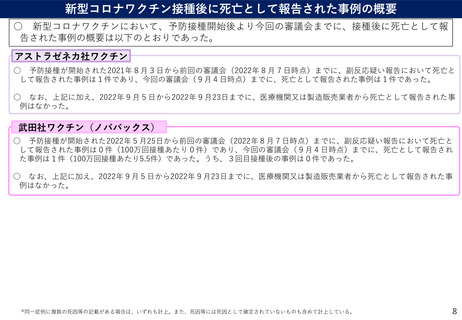
VAERSに報告された581件の有害事象のうち、99.5%は非重篤事象※4であった。
3回目接種後の心筋炎や死亡の報告はなかった。
※1
※2
※3
※4
新型コロナワクチン接種後の有害事象のモニタリングのためにCDCが開発した、スマートフォンを用いた任意登録制の積極的サーベイランスシステム。
CDC及びFDAが管理する、予防接種後の有害事象の報告を収集する受動的サーベイランスシステム。
通常の日常生活が送れなくなった、学校を休んだ、医療機関で治療を受けた、と報告された人を含む。
VAERSの報告のうち、入院、入院期間の延長、命にかかわる疾患、後遺障害、先天性異常または欠損、及び死亡は、重篤に分類される。
14
○ 米国においてファイザー社ワクチンの3回目接種を受けた5ー11歳の小児のうち、v-safeに報告さ
れた局所・全身反応と健康への影響、及びVAERSに報告された有害事象を解析。
○ ファイザー社ワクチンの2回目、3回目接種後の局所反応の出現頻度はそれぞれ68.0%、68.5%、全
身反応はそれぞれ45.8%、45.6%であり、いずれも有意差はみられなかった。
Safety Monitoring of Pfizer-BioNTech COVID-19 Vaccine Booster Doses Among Children Aged 5–11 Years — United
States, May 17–July 31, 2022.(MMWR Morb Mortal Wkly Rep August 19, 2022;71:1047–1051)
表
研究方法:米国において2022年5月17日から7月31日の期間にファイザー社ワク
チンの3回目接種を受けた5ー11歳の小児のうち、予防接種後サーベイランスシ
ステム(v-safe※1)登録者、及びワクチン有害事象報告システム(VAERS ※2)へ
の報告者が対象。v-safeに報告された局所・全身反応と健康への影響※3、及び
VAERSに報告された有害事象を解析した観察研究。
5-11歳の小児におけるファイザー社ワクチン
の1~3回目接種後にv-safeに報告された局所・
全身反応と健康への影響
結果:
v-safeの登録者のうち、1~3回目接種の全てをファイザー社ワクチンで実施し
た3,249名が解析された。接種後1週間において報告された局所・全身反応の頻度
は、2回目接種後と3回目接種後で比較して以下のとおりであり、有意差はみら
れなかった。
・局所反応
2回目接種後:68.0%
3回目接種後:68.5%
・全身反応
2回目接種後:45.8%
3回目接種後:45.6%
VAERSに報告された581件の有害事象のうち、99.5%は非重篤事象※4であった。
3回目接種後の心筋炎や死亡の報告はなかった。
※1
※2
※3
※4
新型コロナワクチン接種後の有害事象のモニタリングのためにCDCが開発した、スマートフォンを用いた任意登録制の積極的サーベイランスシステム。
CDC及びFDAが管理する、予防接種後の有害事象の報告を収集する受動的サーベイランスシステム。
通常の日常生活が送れなくなった、学校を休んだ、医療機関で治療を受けた、と報告された人を含む。
VAERSの報告のうち、入院、入院期間の延長、命にかかわる疾患、後遺障害、先天性異常または欠損、及び死亡は、重篤に分類される。
14