よむ、つかう、まなぶ。
【資料4】医薬・生活衛生局からの定期報告 (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27999.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第9回 9/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
※2
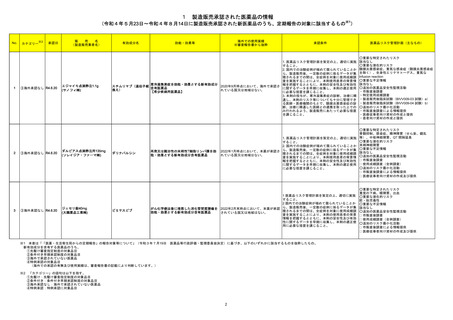
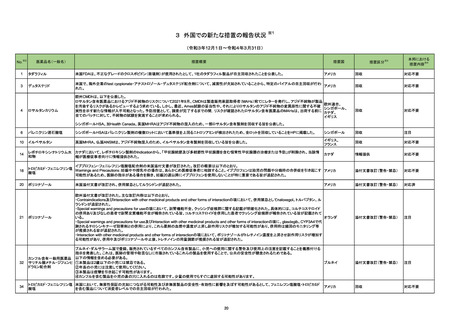
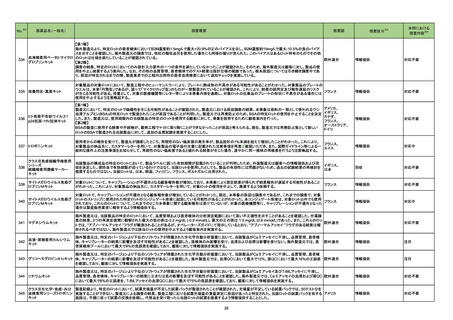
No.
医薬品名(一般名)
措置概要
措置国
65
クロベタゾン酪酸エステル
ジフロラゾン酢酸エステル
オキシテトラサイクリン塩酸
塩・ヒドロコルチゾン
オキシテトラサイクリン塩酸
塩・ヒドロコルチゾン含有一
般用医薬品
トリアムシノロンアセトニド
フルオシノロンアセトニド
プレドニゾロン
プレドニゾロン吉草酸エステ
ル酢酸エステル
ベタメタゾンジプロピオン酸エ
ステル
ベタメタゾン吉草酸エステル
71
ジクロフェナクナトリウム
ブルネイ・ダルサラーム国医薬品管理局は国内で登録、販売されている全てのジクロフェナク含有外用剤に、妊婦への使用に関する以下の情報を更新する指
ジクロフェナクナトリウム含有 示を発表した。
ブルネイ
一般用医薬品
妊娠後期には使用しないこと。
73
メトロニダゾール
77
78
82
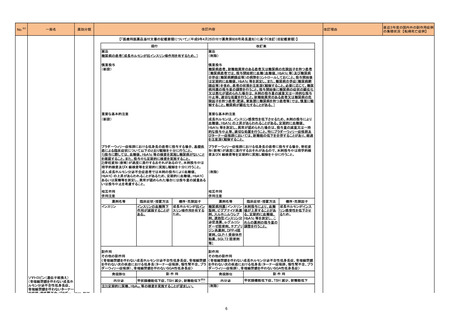
米国CDCはCOVID-19関連のムコール症について、米国アーカンソー州保険局(ADH)の調査結果を公表し、COVID-19罹患患者のムコール症の発症につい
て注意喚起を行った。
●2021年9月17日から24日にかけて、3人の臨床医が米国アーカンソー州保険局(ADH)に対してCOVID-19罹患後のムコール症患者を報告した。
●2021年10月11日、ADHはアーカンソー州におけるCOVID-19関連のムコール症の調査結果について、以下内容を米国全体に周知した。
アメリカ
・2021年7月12日から2021年9月28日にかけて、ADHに対し、COVID-19関連のムコール症が10例報告された。
・COVID-19に対して、10例のうち9例がコルチコステロイド治療を受けていた。
・10例のうち6例が入院中又は退院後1週間以内に死亡した。
※3
措置区分
本邦における
措置内容※4
情報提供
対応済
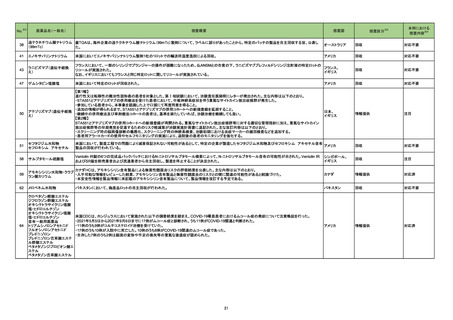
添付文書改訂(警告・禁忌)
対応済
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項にコケイン症候群の患者を追記。
アメリカ
・Adverse Reactionsの項に、コケイン症候群患者へのメトロニダゾールの全身使用において、急速に発症し致死的転帰を伴う症例を含む、重度の不可逆的肝
毒性、急性肝不全の症例が報告されている旨を追記。
添付文書改訂(警告・禁忌)
注目
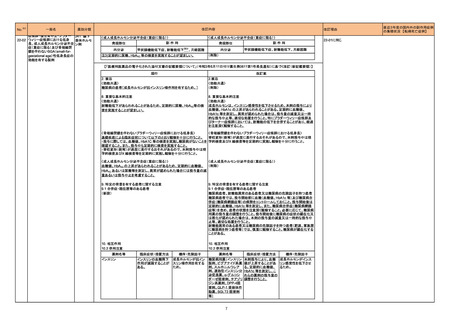
アロプリノール
シンガポール保健科学庁(HSA)は医療従事者に対し、アロプリノール使用に伴う重度皮膚有害反応(SCAR)のリスクと、治療開始前のHLA-B*5801遺伝子型
判定の有用性について注意喚起を行った。アロプリノール治療開始前のHLA-B*5801遺伝子型判定は必須ではないものの、腎機能障害や高齢といったアロプ シンガポール
リノール誘発性SCARリスクを既往とする患者に対しては、遺伝子型判定を検討すべきとであると勧告された。
情報提供
対応済
ボリコナゾール
ボリコナゾール注射剤の米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項において、イバブラジン、naloxegol、トルバプタン、慢性リンパ球性白血病または小リンパ球性リンパ腫の用量漸増期のベネトクラクス
との併用が禁忌である旨、低用量のリトナビル(100mg/12時間)との併用はベネフィットリスク評価を行わない限り避けるべきである旨を追記。
・Warnings and PrecautionsのHepatic Toxicityの項に、小児集団でより高頻度の肝酵素上昇が認められた旨を追記。
・Warnings and PrecautionsのPancreatitisの項に、本剤により治療中の患者で膵炎がみられている旨を追記。
・Warnings and PrecautionsのSevere Cutaneous Adverse Reactionsの項に、本剤による治療中に報告されている重度の皮膚有害事象として、中毒性表皮
壊死融解症(TEN)及び好酸球増加と全身症状を伴う薬物反応(DRESS)を追記。
・Warnings and PrecautionsにPhotosensitivityの項を新設し、ボリコナゾール注射剤は光線皮膚過敏反応に関連しており、治療中は太陽光への直接曝露を
避けて衣服や高SPFの日焼け止めなどの対策をとるべきである旨を追記。
・Warnings and PrecautionsにRenal toxicityの項を新設し、本剤に含まれるヒドロキシプロピル-β-シクロデキストリン(HPβCD)は糸球体ろ過により消失する アメリカ
ため、中等度から重度の腎機能障害患者においてHPβCDが蓄積する旨を追記。また、本剤による治療中に急性腎障害が報告されている旨を追記。
・Warnings and PrecautionsにAdrenal Dysfunctionの項を新設し、本剤を含むアゾール系薬剤を投与中の患者において可逆的な副腎機能不全が報告され
ている旨、コルチコステロイドと併用している患者でクッシング症候群が報告されている旨を追記。
・Warnings and PrecautionsのEmbryo-Fetal Toxicityの項に生殖脳を有する女性には、本剤の治療中は効果的な避妊を行うよう助言する旨を追記。
・Adverse ReactionsのPostmarketing Experienceの項に、視神経や鬱血乳頭などの長期にわたる視覚的副作用、DRESS、コルチコステロイドと併用時の
クッシング症候群、小児患者で膵炎が報告されている旨、を追記。
・Use in Specific PopulationsのPregnancyの項に、妊娠ラットへの投与でボリコナゾールが奇形と関連していた旨、妊娠ウサギへの投与でボリコナゾールが
母体毒性による着床後の損失増加と胎児体重減少に関連していた旨、等の動物試験結果を追記。
・Use in Specific PopulationsのPediatric Useの項に、2歳未満の患者における安全性及び有効性は確立していないため投与は推奨されない旨、小児におい
て肝酵素上昇が高頻度で認められている旨、光毒性の頻度は小児において高い旨、等を追記。
添付文書改訂(警告・禁忌)
対応不要
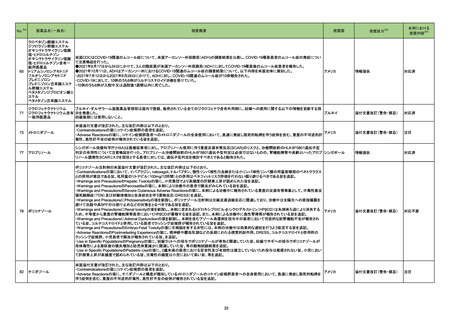
チニダゾール
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項にコケイン症候群の患者を追記。
アメリカ
・Adverse Reactionsの項に、チニダゾールと構造が類似しているメトロニダゾールのコケイン症候群患者への全身使用において、急速に発症し致死的転帰を
伴う症例を含む、重度の不可逆的肝毒性、急性肝不全の症例が報告されている旨を追記。
添付文書改訂(警告・禁忌)
注目
22
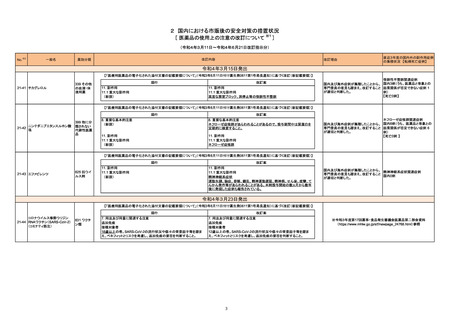
No.
医薬品名(一般名)
措置概要
措置国
65
クロベタゾン酪酸エステル
ジフロラゾン酢酸エステル
オキシテトラサイクリン塩酸
塩・ヒドロコルチゾン
オキシテトラサイクリン塩酸
塩・ヒドロコルチゾン含有一
般用医薬品
トリアムシノロンアセトニド
フルオシノロンアセトニド
プレドニゾロン
プレドニゾロン吉草酸エステ
ル酢酸エステル
ベタメタゾンジプロピオン酸エ
ステル
ベタメタゾン吉草酸エステル
71
ジクロフェナクナトリウム
ブルネイ・ダルサラーム国医薬品管理局は国内で登録、販売されている全てのジクロフェナク含有外用剤に、妊婦への使用に関する以下の情報を更新する指
ジクロフェナクナトリウム含有 示を発表した。
ブルネイ
一般用医薬品
妊娠後期には使用しないこと。
73
メトロニダゾール
77
78
82
米国CDCはCOVID-19関連のムコール症について、米国アーカンソー州保険局(ADH)の調査結果を公表し、COVID-19罹患患者のムコール症の発症につい
て注意喚起を行った。
●2021年9月17日から24日にかけて、3人の臨床医が米国アーカンソー州保険局(ADH)に対してCOVID-19罹患後のムコール症患者を報告した。
●2021年10月11日、ADHはアーカンソー州におけるCOVID-19関連のムコール症の調査結果について、以下内容を米国全体に周知した。
アメリカ
・2021年7月12日から2021年9月28日にかけて、ADHに対し、COVID-19関連のムコール症が10例報告された。
・COVID-19に対して、10例のうち9例がコルチコステロイド治療を受けていた。
・10例のうち6例が入院中又は退院後1週間以内に死亡した。
※3
措置区分
本邦における
措置内容※4
情報提供
対応済
添付文書改訂(警告・禁忌)
対応済
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項にコケイン症候群の患者を追記。
アメリカ
・Adverse Reactionsの項に、コケイン症候群患者へのメトロニダゾールの全身使用において、急速に発症し致死的転帰を伴う症例を含む、重度の不可逆的肝
毒性、急性肝不全の症例が報告されている旨を追記。
添付文書改訂(警告・禁忌)
注目
アロプリノール
シンガポール保健科学庁(HSA)は医療従事者に対し、アロプリノール使用に伴う重度皮膚有害反応(SCAR)のリスクと、治療開始前のHLA-B*5801遺伝子型
判定の有用性について注意喚起を行った。アロプリノール治療開始前のHLA-B*5801遺伝子型判定は必須ではないものの、腎機能障害や高齢といったアロプ シンガポール
リノール誘発性SCARリスクを既往とする患者に対しては、遺伝子型判定を検討すべきとであると勧告された。
情報提供
対応済
ボリコナゾール
ボリコナゾール注射剤の米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項において、イバブラジン、naloxegol、トルバプタン、慢性リンパ球性白血病または小リンパ球性リンパ腫の用量漸増期のベネトクラクス
との併用が禁忌である旨、低用量のリトナビル(100mg/12時間)との併用はベネフィットリスク評価を行わない限り避けるべきである旨を追記。
・Warnings and PrecautionsのHepatic Toxicityの項に、小児集団でより高頻度の肝酵素上昇が認められた旨を追記。
・Warnings and PrecautionsのPancreatitisの項に、本剤により治療中の患者で膵炎がみられている旨を追記。
・Warnings and PrecautionsのSevere Cutaneous Adverse Reactionsの項に、本剤による治療中に報告されている重度の皮膚有害事象として、中毒性表皮
壊死融解症(TEN)及び好酸球増加と全身症状を伴う薬物反応(DRESS)を追記。
・Warnings and PrecautionsにPhotosensitivityの項を新設し、ボリコナゾール注射剤は光線皮膚過敏反応に関連しており、治療中は太陽光への直接曝露を
避けて衣服や高SPFの日焼け止めなどの対策をとるべきである旨を追記。
・Warnings and PrecautionsにRenal toxicityの項を新設し、本剤に含まれるヒドロキシプロピル-β-シクロデキストリン(HPβCD)は糸球体ろ過により消失する アメリカ
ため、中等度から重度の腎機能障害患者においてHPβCDが蓄積する旨を追記。また、本剤による治療中に急性腎障害が報告されている旨を追記。
・Warnings and PrecautionsにAdrenal Dysfunctionの項を新設し、本剤を含むアゾール系薬剤を投与中の患者において可逆的な副腎機能不全が報告され
ている旨、コルチコステロイドと併用している患者でクッシング症候群が報告されている旨を追記。
・Warnings and PrecautionsのEmbryo-Fetal Toxicityの項に生殖脳を有する女性には、本剤の治療中は効果的な避妊を行うよう助言する旨を追記。
・Adverse ReactionsのPostmarketing Experienceの項に、視神経や鬱血乳頭などの長期にわたる視覚的副作用、DRESS、コルチコステロイドと併用時の
クッシング症候群、小児患者で膵炎が報告されている旨、を追記。
・Use in Specific PopulationsのPregnancyの項に、妊娠ラットへの投与でボリコナゾールが奇形と関連していた旨、妊娠ウサギへの投与でボリコナゾールが
母体毒性による着床後の損失増加と胎児体重減少に関連していた旨、等の動物試験結果を追記。
・Use in Specific PopulationsのPediatric Useの項に、2歳未満の患者における安全性及び有効性は確立していないため投与は推奨されない旨、小児におい
て肝酵素上昇が高頻度で認められている旨、光毒性の頻度は小児において高い旨、等を追記。
添付文書改訂(警告・禁忌)
対応不要
チニダゾール
米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項にコケイン症候群の患者を追記。
アメリカ
・Adverse Reactionsの項に、チニダゾールと構造が類似しているメトロニダゾールのコケイン症候群患者への全身使用において、急速に発症し致死的転帰を
伴う症例を含む、重度の不可逆的肝毒性、急性肝不全の症例が報告されている旨を追記。
添付文書改訂(警告・禁忌)
注目
22