よむ、つかう、まなぶ。
【資料4】医薬・生活衛生局からの定期報告 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27999.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第9回 9/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
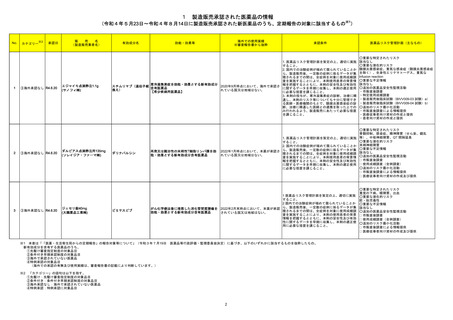
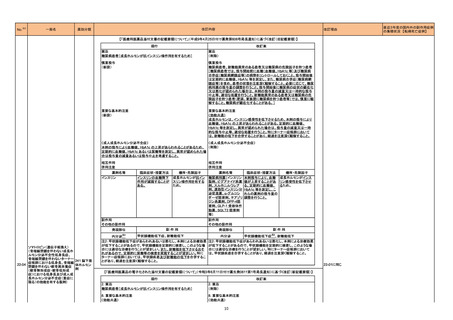
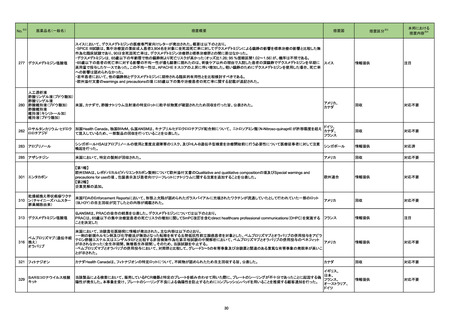
1 製造販売承認された医薬品の情報
(令和4年5月23日~令和4年8月14日に製造販売承認された新医薬品のうち、定期報告の対象に該当するもの※1)
No.
1
2
3
カテゴリー
※2
承認日
③海外承認なし R4.6.20
③海外承認なし R4.6.20
③海外承認なし R4.6.20
販
売
名
(製造販売業者名)
エジャイモ点滴静注1.1g
(サノフィ㈱)
ダルビアス点滴静注用135mg
(ソレイジア・ファーマ㈱)
ジェセリ錠40mg
(大鵬薬品工業㈱)
有効成分名
承認条件
1. 医薬品リスク管理計画を策定の上、適切に実施
すること。
2. 国内での治験症例が極めて限られていることか
ら、製造販売後、一定数の症例に係るデータが集
積されるまでの間は、全症例を対象に使用成績調
査を実施することにより、本剤使用患者の背景情
寒冷凝集素症を効能・効果とする新有効成分
スチムリマブ(遺伝子組
2020年9月時点において、海外で承認さ 報を把握するとともに、本剤の安全性及び有効性
含有医薬品
に関するデータを早期に収集し、本剤の適正使用
換え)
れている国又は地域はない。
【希少疾病用医薬品】
に必要な措置を講じること。
3. 本剤の投与が、寒冷凝集素症の診断、治療に精
通し、本剤のリスク等についても十分に管理でき
る医師・医療機関のもとで、髄膜炎菌感染症の診
断、治療に精通した医師との連携を取った上での
み行われるよう、製造販売にあたって必要な措置
を講じること。
1. 医薬品リスク管理計画を策定の上、適切に実施
すること。
2. 国内での治験症例が極めて限られていることか
2022年1月時点において、本薬が承認さ ら、製造販売後、一定数の症例に係るデータが集
積されるまでの間は、全症例を対象に使用成績調
れている国又は地域はない。
査を実施することにより、本剤使用患者の背景情
報を把握するとともに、本剤の安全性及び有効性
に関するデータを早期に収集し、本剤の適正使用
に必要な措置を講じること。
ダリナパルシン
再発又は難治性の末梢性T細胞リンパ腫を効
能・効果とする新有効成分含有医薬品
ピミテスピブ
1 医薬品リスク管理計画を策定の上、適切に実施
すること。
2 国内での治験症例が極めて限られていることか
がん化学療法後に増悪した消化管間質腫瘍を 2022年2月末時点において、本薬が承認 ら、製造販売後、一定数の症例に係るデータが集
積されるまでの間は、全症例を対象に使用成績調
効能・効果とする新有効成分含有医薬品
されている国又は地域はない。
査を実施することにより、本剤の使用患者の背景
情報を把握するとともに、本剤の安全性及び有効
性に関するデータを早期に収集し、本剤の適正使
用に必要な措置を講じること。
※1 本表は「「医薬・生活衛生局からの定期報告」の報告対象等について」(令和3年7月19日
新有効成分を含有する医薬品のうち、
①先駆け審査指定制度の対象品目
②条件付き早期承認制度の対象品目
③海外で承認されていない医薬品
④特例承認の対象品目
(海外での承認の有無及び使用実績は、審査報告書の記載により判断しています。)
※2
海外での使用実績
※審査報告書から抜粋
効能・効果等
医薬品等行政評価・監視委員会決定)に基づき、以下のいずれかに該当するものを抜粋したもの。
「カテゴリー」の語句は以下を指す。
①先駆け:先駆け審査指定制度の対象品目
②条件付き:条件付き早期承認制度の対象品目
③海外承認なし:海外で承認されていない医薬品
④特例承認:特例承認に対象品目
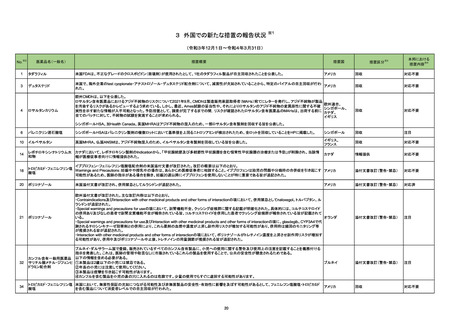
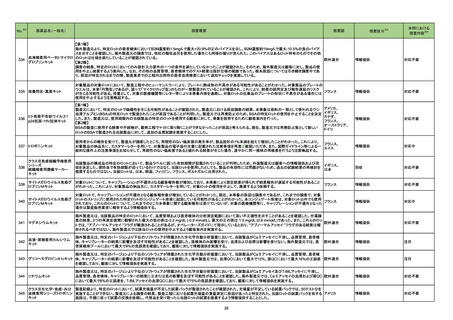
2
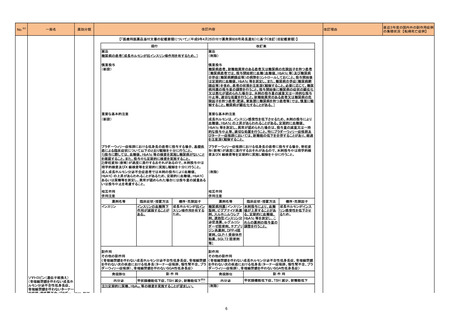
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
該当なし
○重要な潜在的リスク
髄膜炎菌感染症、重篤な感染症(髄膜炎菌感染症
を除く)、全身性エリテマトーデス、重篤な
infusion reaction
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・特定使用成績調査
・製造販売後臨床試験(BIVV009-03 試験)a)
・製造販売後臨床試験(BIVV009-04 試験)b)
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材の作成と提供
・患者向け資材の作成と提供
○重要な特定されたリスク
骨髄抑制、感染症、精神障害(せん妄、錯乱
等)、中枢神経障害、QT 間隔延長
○重要な潜在的リスク
末梢神経障害
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
市販直後調査
使用成績調査(全例調査)
○追加のリスク最小化活動
市販直後調査による情報提供
医療従事者向け資材の作成及び提供
○重要な特定されたリスク
重度の下痢、眼障害、出血
○重要な潜在的リスク
胚・胎児毒性
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
市販直後調査
使用成績調査(全例調査)
○追加のリスク最小化活動
市販直後調査による情報提供
医療従事者向け資材の作成及び提供
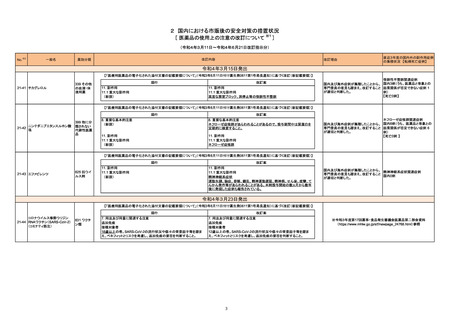
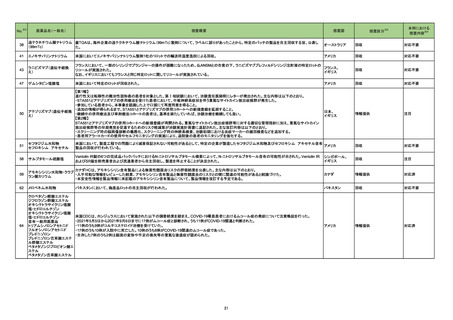
(令和4年5月23日~令和4年8月14日に製造販売承認された新医薬品のうち、定期報告の対象に該当するもの※1)
No.
1
2
3
カテゴリー
※2
承認日
③海外承認なし R4.6.20
③海外承認なし R4.6.20
③海外承認なし R4.6.20
販
売
名
(製造販売業者名)
エジャイモ点滴静注1.1g
(サノフィ㈱)
ダルビアス点滴静注用135mg
(ソレイジア・ファーマ㈱)
ジェセリ錠40mg
(大鵬薬品工業㈱)
有効成分名
承認条件
1. 医薬品リスク管理計画を策定の上、適切に実施
すること。
2. 国内での治験症例が極めて限られていることか
ら、製造販売後、一定数の症例に係るデータが集
積されるまでの間は、全症例を対象に使用成績調
査を実施することにより、本剤使用患者の背景情
寒冷凝集素症を効能・効果とする新有効成分
スチムリマブ(遺伝子組
2020年9月時点において、海外で承認さ 報を把握するとともに、本剤の安全性及び有効性
含有医薬品
に関するデータを早期に収集し、本剤の適正使用
換え)
れている国又は地域はない。
【希少疾病用医薬品】
に必要な措置を講じること。
3. 本剤の投与が、寒冷凝集素症の診断、治療に精
通し、本剤のリスク等についても十分に管理でき
る医師・医療機関のもとで、髄膜炎菌感染症の診
断、治療に精通した医師との連携を取った上での
み行われるよう、製造販売にあたって必要な措置
を講じること。
1. 医薬品リスク管理計画を策定の上、適切に実施
すること。
2. 国内での治験症例が極めて限られていることか
2022年1月時点において、本薬が承認さ ら、製造販売後、一定数の症例に係るデータが集
積されるまでの間は、全症例を対象に使用成績調
れている国又は地域はない。
査を実施することにより、本剤使用患者の背景情
報を把握するとともに、本剤の安全性及び有効性
に関するデータを早期に収集し、本剤の適正使用
に必要な措置を講じること。
ダリナパルシン
再発又は難治性の末梢性T細胞リンパ腫を効
能・効果とする新有効成分含有医薬品
ピミテスピブ
1 医薬品リスク管理計画を策定の上、適切に実施
すること。
2 国内での治験症例が極めて限られていることか
がん化学療法後に増悪した消化管間質腫瘍を 2022年2月末時点において、本薬が承認 ら、製造販売後、一定数の症例に係るデータが集
積されるまでの間は、全症例を対象に使用成績調
効能・効果とする新有効成分含有医薬品
されている国又は地域はない。
査を実施することにより、本剤の使用患者の背景
情報を把握するとともに、本剤の安全性及び有効
性に関するデータを早期に収集し、本剤の適正使
用に必要な措置を講じること。
※1 本表は「「医薬・生活衛生局からの定期報告」の報告対象等について」(令和3年7月19日
新有効成分を含有する医薬品のうち、
①先駆け審査指定制度の対象品目
②条件付き早期承認制度の対象品目
③海外で承認されていない医薬品
④特例承認の対象品目
(海外での承認の有無及び使用実績は、審査報告書の記載により判断しています。)
※2
海外での使用実績
※審査報告書から抜粋
効能・効果等
医薬品等行政評価・監視委員会決定)に基づき、以下のいずれかに該当するものを抜粋したもの。
「カテゴリー」の語句は以下を指す。
①先駆け:先駆け審査指定制度の対象品目
②条件付き:条件付き早期承認制度の対象品目
③海外承認なし:海外で承認されていない医薬品
④特例承認:特例承認に対象品目
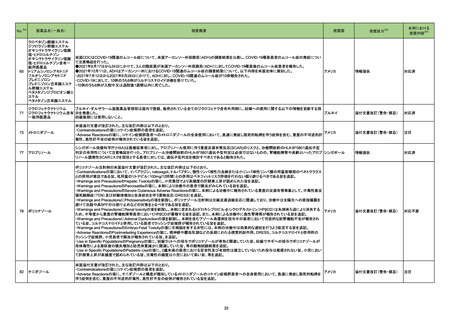
2
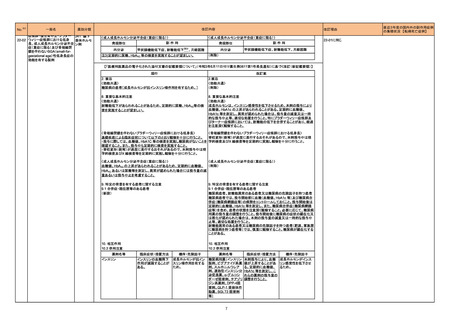
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
該当なし
○重要な潜在的リスク
髄膜炎菌感染症、重篤な感染症(髄膜炎菌感染症
を除く)、全身性エリテマトーデス、重篤な
infusion reaction
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・特定使用成績調査
・製造販売後臨床試験(BIVV009-03 試験)a)
・製造販売後臨床試験(BIVV009-04 試験)b)
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向け資材の作成と提供
・患者向け資材の作成と提供
○重要な特定されたリスク
骨髄抑制、感染症、精神障害(せん妄、錯乱
等)、中枢神経障害、QT 間隔延長
○重要な潜在的リスク
末梢神経障害
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
市販直後調査
使用成績調査(全例調査)
○追加のリスク最小化活動
市販直後調査による情報提供
医療従事者向け資材の作成及び提供
○重要な特定されたリスク
重度の下痢、眼障害、出血
○重要な潜在的リスク
胚・胎児毒性
○重要な不足情報
該当なし
○追加の医薬品安全性監視活動
市販直後調査
使用成績調査(全例調査)
○追加のリスク最小化活動
市販直後調査による情報提供
医療従事者向け資材の作成及び提供