よむ、つかう、まなぶ。
【資料4】医薬・生活衛生局からの定期報告 (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27999.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第9回 9/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
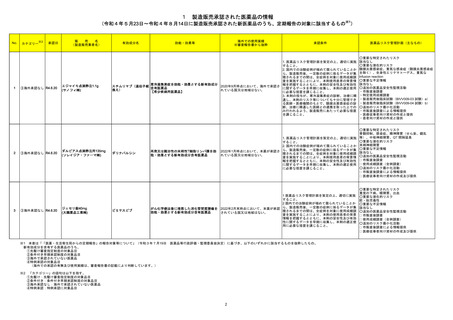
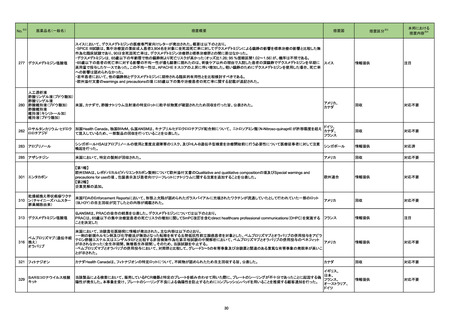
No.※2
一般名
改訂内容
薬効分類
改訂理由
直近3年度の国内外の副作用症例
の集積状況 【転帰死亡症例】
22-09と同じ
22-09と同じ
【「医療用医薬品添付文書の記載要領について」(平成9年4月25日付け薬発第606号局長通知)に基づく改訂(旧記載要領)】
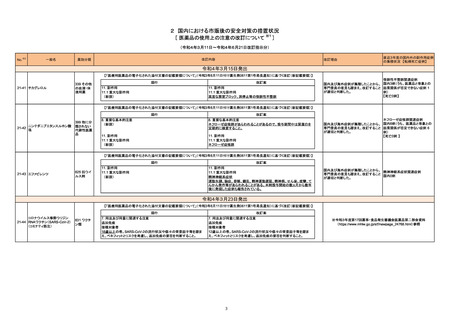
現行
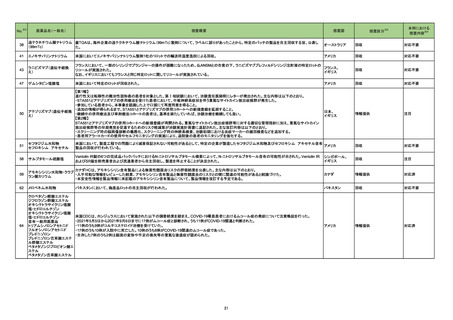
ベタメタゾン・d-クロルフェニラミ
245 副腎ホ
22-14 ンマレイン酸塩
ベタメタゾンリン酸エステルナト ルモン剤
リウム(注射剤)
改訂案
慎重投与
(新設)
慎重投与
褐色細胞腫又はパラガングリオーマのある患者及びその疑いのある患者
[褐色細胞腫クリーゼがあらわれることがある。]
重要な基本的注意
(新設)
重要な基本的注意
褐色細胞腫の合併を認識していなかった状態でベタメタゾン製剤(注射
剤)を投与した際に褐色細胞腫クリーゼを発現したとの報告がある。本剤
投与後に著明な血圧上昇、頭痛、動悸等が認められた場合は、褐色細胞
腫クリーゼの発現を考慮した上で適切な処置を行うこと。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
改訂案
8. 重要な基本的注意
(新設)
8. 重要な基本的注意
褐色細胞腫の合併を認識していなかった状態でベタメタゾン製剤(注射
剤)を投与した際に褐色細胞腫クリーゼを発現したとの報告がある。本剤
投与後に著明な血圧上昇、頭痛、動悸等が認められた場合は、褐色細胞
腫クリーゼの発現を考慮した上で適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
褐色細胞腫又はパラガングリオーマのある患者及びその疑いのある患者
褐色細胞腫クリーゼがあらわれることがある。
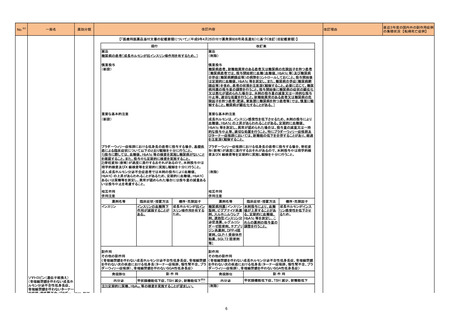
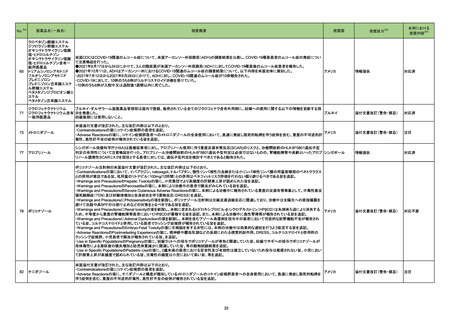
【「医療用医薬品添付文書の記載要領について」(平成9年4月25日付け薬発第606号局長通知)に基づく改訂(旧記載要領)】
現行
改訂案
副作用
重大な副作用
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜
眼症候群(Stevens-Johnson 症候群)、紅皮症(剥脱性皮膚炎):
22-15 テイコプラニン
611 主とし
てグラム陽
性菌に作用
するもの
副作用
重大な副作用
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜
眼症候群(Stevens-Johnson 症候群)、急性汎発性発疹性膿疱症、紅皮
症(剥脱性皮膚炎):
中毒性表皮壊死融解症、皮膚粘膜眼症候群、紅皮症(剥脱性皮膚炎)が 中毒性表皮壊死融解症、皮膚粘膜眼症候群、急性汎発性発疹性膿疱
あらわれることがあるので、観察を十分に行い、異常が認められた場合に 症、紅皮症(剥脱性皮膚炎)があらわれることがあるので、観察を十分に
は投与を中止し、適切な処置を行うこと。
行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
(注)患者向医薬品ガイドを作成する医薬品に特定する。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
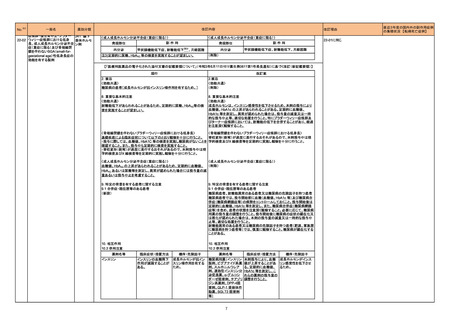
11. 副作用
11.1 重大な副作用
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜
眼症候群(Stevens-Johnson 症候群)、紅皮症(剥脱性皮膚炎)
改訂案
11. 副作用
11.1 重大な副作用
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜
眼症候群(Stevens-Johnson 症候群)、急性汎発性発疹性膿疱症、紅皮
症(剥脱性皮膚炎)
(注)患者向医薬品ガイドを作成する医薬品に特定する。
16
評価症例のうち、「急性汎発性発
疹性膿疱症」の直近3 年度の集積
国内及び海外症例を評価し、専門委員 状況は以下のとおり。
の意見も聴取した結果、使用上の注意を ・国内0 例
・海外2 例(うち、医薬品と事象との
改訂することが適切と判断した。
因果関係が否定できない症例1例)
【死亡0 例】
一般名
改訂内容
薬効分類
改訂理由
直近3年度の国内外の副作用症例
の集積状況 【転帰死亡症例】
22-09と同じ
22-09と同じ
【「医療用医薬品添付文書の記載要領について」(平成9年4月25日付け薬発第606号局長通知)に基づく改訂(旧記載要領)】
現行
ベタメタゾン・d-クロルフェニラミ
245 副腎ホ
22-14 ンマレイン酸塩
ベタメタゾンリン酸エステルナト ルモン剤
リウム(注射剤)
改訂案
慎重投与
(新設)
慎重投与
褐色細胞腫又はパラガングリオーマのある患者及びその疑いのある患者
[褐色細胞腫クリーゼがあらわれることがある。]
重要な基本的注意
(新設)
重要な基本的注意
褐色細胞腫の合併を認識していなかった状態でベタメタゾン製剤(注射
剤)を投与した際に褐色細胞腫クリーゼを発現したとの報告がある。本剤
投与後に著明な血圧上昇、頭痛、動悸等が認められた場合は、褐色細胞
腫クリーゼの発現を考慮した上で適切な処置を行うこと。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
改訂案
8. 重要な基本的注意
(新設)
8. 重要な基本的注意
褐色細胞腫の合併を認識していなかった状態でベタメタゾン製剤(注射
剤)を投与した際に褐色細胞腫クリーゼを発現したとの報告がある。本剤
投与後に著明な血圧上昇、頭痛、動悸等が認められた場合は、褐色細胞
腫クリーゼの発現を考慮した上で適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
褐色細胞腫又はパラガングリオーマのある患者及びその疑いのある患者
褐色細胞腫クリーゼがあらわれることがある。
【「医療用医薬品添付文書の記載要領について」(平成9年4月25日付け薬発第606号局長通知)に基づく改訂(旧記載要領)】
現行
改訂案
副作用
重大な副作用
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜
眼症候群(Stevens-Johnson 症候群)、紅皮症(剥脱性皮膚炎):
22-15 テイコプラニン
611 主とし
てグラム陽
性菌に作用
するもの
副作用
重大な副作用
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜
眼症候群(Stevens-Johnson 症候群)、急性汎発性発疹性膿疱症、紅皮
症(剥脱性皮膚炎):
中毒性表皮壊死融解症、皮膚粘膜眼症候群、紅皮症(剥脱性皮膚炎)が 中毒性表皮壊死融解症、皮膚粘膜眼症候群、急性汎発性発疹性膿疱
あらわれることがあるので、観察を十分に行い、異常が認められた場合に 症、紅皮症(剥脱性皮膚炎)があらわれることがあるので、観察を十分に
は投与を中止し、適切な処置を行うこと。
行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。
(注)患者向医薬品ガイドを作成する医薬品に特定する。
【「医療用医薬品の電子化された添付文書の記載要領について」(令和3年6月11日付け薬生発0611第1号局長通知)に基づく改訂(新記載要領)】
現行
11. 副作用
11.1 重大な副作用
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜
眼症候群(Stevens-Johnson 症候群)、紅皮症(剥脱性皮膚炎)
改訂案
11. 副作用
11.1 重大な副作用
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜
眼症候群(Stevens-Johnson 症候群)、急性汎発性発疹性膿疱症、紅皮
症(剥脱性皮膚炎)
(注)患者向医薬品ガイドを作成する医薬品に特定する。
16
評価症例のうち、「急性汎発性発
疹性膿疱症」の直近3 年度の集積
国内及び海外症例を評価し、専門委員 状況は以下のとおり。
の意見も聴取した結果、使用上の注意を ・国内0 例
・海外2 例(うち、医薬品と事象との
改訂することが適切と判断した。
因果関係が否定できない症例1例)
【死亡0 例】