よむ、つかう、まなぶ。
資料2-1 令和3年度の安全対策について (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26332.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第1回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
た場合には、その必要性・妥当性も含め、個別に適否を検討することとする。
先発品企業と後発品企業との安全管理体制の共有の是非については、個別の後発品
企業の判断に委ねるものとする。
先発品企業と後発品企業の間の連携の在り方、特にシステム等の安全管理体制を共
有する場合の具体的な手順の在り方については、別途検討することとする。
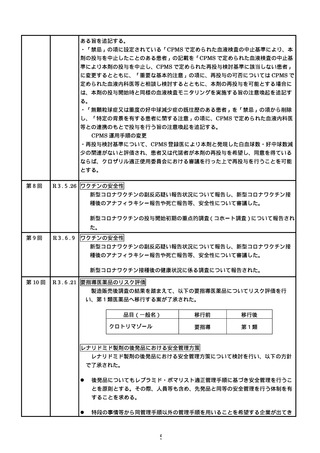
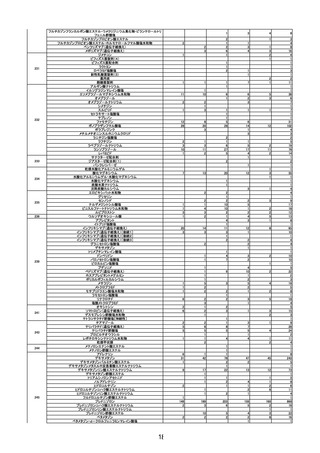
レブラミド・ポマリスト適正管理手順(RevMate)の改訂
○
レナリドミド製剤及びポマリドミド製剤の製造販売業者であるセルジーン株式会社
がブリストル・マイヤーズ スクイブ株式会社に統合される機会に合わせ、RevMate
の改訂が行われたことを報告した。主な改訂内容は、製造販売業者の統合に伴う企業
名の変更、プロモーション活動から分離した「RevMate 担当者」の設置、医療機関へ
の定期的な訪問の実施である。
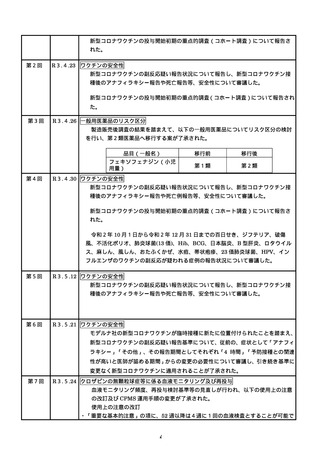
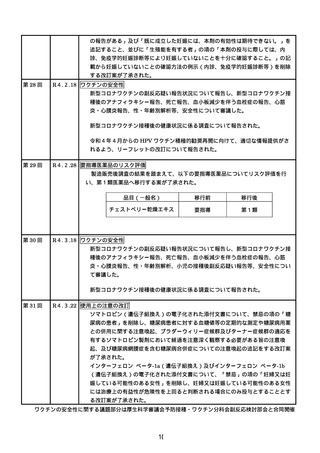
第 11 回※ R3.6.23 ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告や死亡報告等、安全性について審議した。新型コロナ
ワクチン接種後の心筋炎・心膜炎について、副反応疑い報告基準への追加に関して
は検討を継続していくこととした。
○ 新規の新型コロナワクチンの接種が開始した場合の副反応疑い報告基準の運用につ
いて審議された。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
第 12 回※
R3.7.7 ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告や死亡報告等、安全性について審議した。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
第 13 回※
R3.7.21 ワクチンの安全性
○ アストラゼネカ社ワクチンの添付文書を改訂し、毛細血管漏出症候群の既往歴のあ
る者を接種不適当者に位置づけるとともに、接種後の血小板減少、毛細血管漏出症
候群、ギラン・バレー症候群に係る注意喚起の実施について審議し、了承された。
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告や死亡報告等、安全性について審議した。心筋炎・心
膜炎については、報告状況を注視していくとともに、引き続き最新の情報の周知及
び注意喚起を行うこととした。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
第 14 回※
R3.7.30 ワクチンの安全性
○ アストラゼネカ社の新型コロナワクチンが新たに臨時接種に位置づけられたことを
踏まえ、新型コロナワクチンの副反応疑い報告基準について、新たに症状として
6
先発品企業と後発品企業との安全管理体制の共有の是非については、個別の後発品
企業の判断に委ねるものとする。
先発品企業と後発品企業の間の連携の在り方、特にシステム等の安全管理体制を共
有する場合の具体的な手順の在り方については、別途検討することとする。
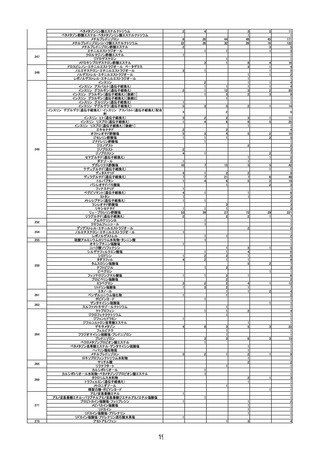
レブラミド・ポマリスト適正管理手順(RevMate)の改訂
○
レナリドミド製剤及びポマリドミド製剤の製造販売業者であるセルジーン株式会社
がブリストル・マイヤーズ スクイブ株式会社に統合される機会に合わせ、RevMate
の改訂が行われたことを報告した。主な改訂内容は、製造販売業者の統合に伴う企業
名の変更、プロモーション活動から分離した「RevMate 担当者」の設置、医療機関へ
の定期的な訪問の実施である。
第 11 回※ R3.6.23 ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告や死亡報告等、安全性について審議した。新型コロナ
ワクチン接種後の心筋炎・心膜炎について、副反応疑い報告基準への追加に関して
は検討を継続していくこととした。
○ 新規の新型コロナワクチンの接種が開始した場合の副反応疑い報告基準の運用につ
いて審議された。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
第 12 回※
R3.7.7 ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告や死亡報告等、安全性について審議した。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
第 13 回※
R3.7.21 ワクチンの安全性
○ アストラゼネカ社ワクチンの添付文書を改訂し、毛細血管漏出症候群の既往歴のあ
る者を接種不適当者に位置づけるとともに、接種後の血小板減少、毛細血管漏出症
候群、ギラン・バレー症候群に係る注意喚起の実施について審議し、了承された。
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告や死亡報告等、安全性について審議した。心筋炎・心
膜炎については、報告状況を注視していくとともに、引き続き最新の情報の周知及
び注意喚起を行うこととした。
○ 新型コロナワクチン接種後の健康状況に係る調査について報告された。
第 14 回※
R3.7.30 ワクチンの安全性
○ アストラゼネカ社の新型コロナワクチンが新たに臨時接種に位置づけられたことを
踏まえ、新型コロナワクチンの副反応疑い報告基準について、新たに症状として
6