よむ、つかう、まなぶ。
資料2-1 令和3年度の安全対策について (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26332.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第1回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
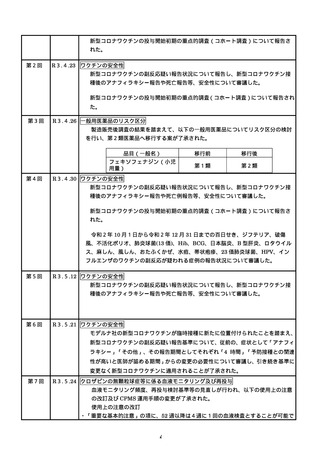
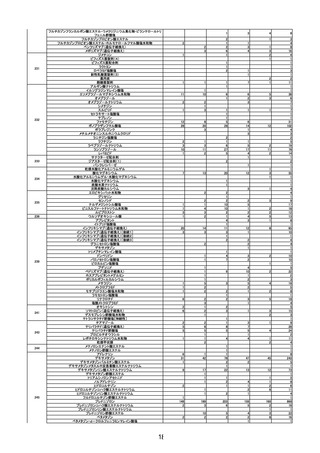
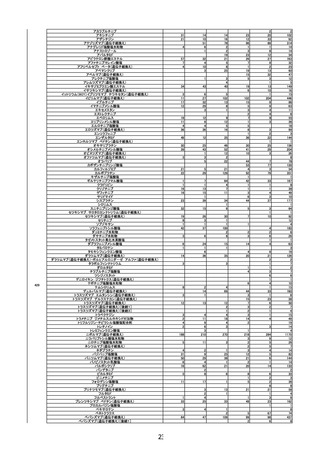
○ 新型コロナワクチンの投与開始初期の重点的調査(コホート調査)について報告さ
れた。
第2回※
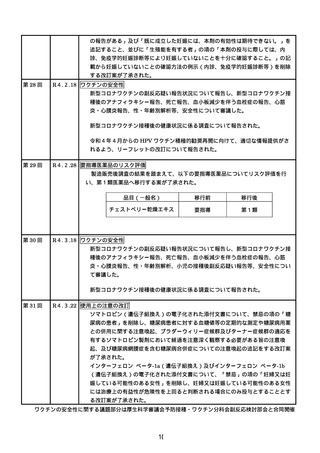
R3.4.23 ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告や死亡報告等、安全性について審議した。
○ 新型コロナワクチンの投与開始初期の重点的調査(コホート調査)について報告され
た。
第3回
R3.4.26 一般用医薬品のリスク区分
○
製造販売後調査の結果を踏まえて、以下の一般用医薬品についてリスク区分の検討
を行い、第2類医薬品へ移行する案が了承された。
第4回※
品目(一般名)
移行前
移行後
フェキソフェナジン(小児
用量)
第1類
第2類
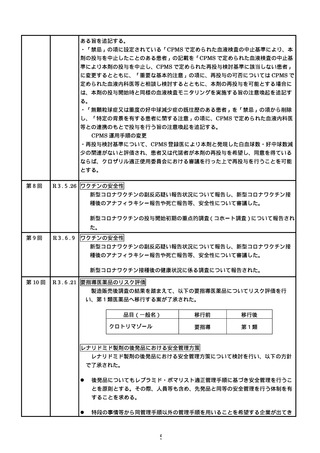
R3.4.30 ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告や死亡例報告等、安全性について審議した。
○ 新型コロナワクチンの投与開始初期の重点的調査(コホート調査)について報告さ
れた。
○
令和2年 10 月1日から令和2年 12 月 31 日までの百日せき、ジフテリア、破傷
風、不活化ポリオ、肺炎球菌(13 価)、Hib、BCG、日本脳炎、B 型肝炎、ロタウイル
ス、麻しん、風しん、おたふくかぜ、水痘、帯状疱疹、23 価肺炎球菌、HPV、イン
フルエンザのワクチンの副反応が疑われる症例の報告状況について審議した。
第5回※
R3.5.12 ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告や死亡報告等、安全性について審議した。
第6回※
R3.5.21 ワクチンの安全性
○ モデルナ社の新型コロナワクチンが臨時接種に新たに位置付けられたことを踏まえ、
新型コロナワクチンの副反応疑い報告基準について、従前の、症状として「アナフィ
ラキシー」「その他」、その報告期間としてそれぞれ「4 時間」「予防接種との関連
性が高いと医師が認める期間」からの変更の必要性について審議し、引き続き基準に
変更なく新型コロナワクチンに適用されることが了承された。
第7回
R3.5.24 クロザピンの無顆粒球症等に係る血液モニタリング及び再投与
○
血液モニタリング頻度、再投与検討基準等の見直しが行われ、以下の使用上の注意
の改訂及び CPMS 運用手順の変更が了承された。
○
使用上の注意の改訂
・「重要な基本的注意」の項に、52 週以降は4週に1回の血液検査とすることが可能で
4
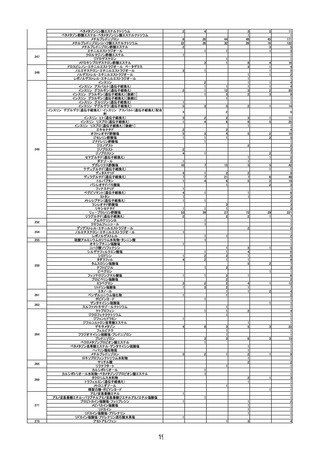
れた。
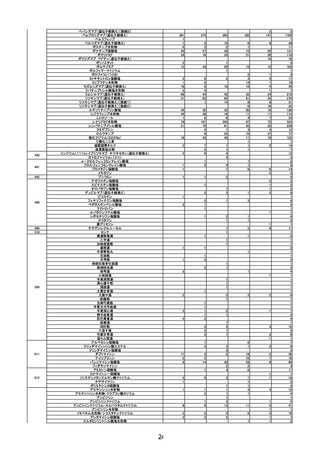
第2回※
R3.4.23 ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告や死亡報告等、安全性について審議した。
○ 新型コロナワクチンの投与開始初期の重点的調査(コホート調査)について報告され
た。
第3回
R3.4.26 一般用医薬品のリスク区分
○
製造販売後調査の結果を踏まえて、以下の一般用医薬品についてリスク区分の検討
を行い、第2類医薬品へ移行する案が了承された。
第4回※
品目(一般名)
移行前
移行後
フェキソフェナジン(小児
用量)
第1類
第2類
R3.4.30 ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告や死亡例報告等、安全性について審議した。
○ 新型コロナワクチンの投与開始初期の重点的調査(コホート調査)について報告さ
れた。
○
令和2年 10 月1日から令和2年 12 月 31 日までの百日せき、ジフテリア、破傷
風、不活化ポリオ、肺炎球菌(13 価)、Hib、BCG、日本脳炎、B 型肝炎、ロタウイル
ス、麻しん、風しん、おたふくかぜ、水痘、帯状疱疹、23 価肺炎球菌、HPV、イン
フルエンザのワクチンの副反応が疑われる症例の報告状況について審議した。
第5回※
R3.5.12 ワクチンの安全性
○ 新型コロナワクチンの副反応疑い報告状況について報告し、新型コロナワクチン接
種後のアナフィラキシー報告や死亡報告等、安全性について審議した。
第6回※
R3.5.21 ワクチンの安全性
○ モデルナ社の新型コロナワクチンが臨時接種に新たに位置付けられたことを踏まえ、
新型コロナワクチンの副反応疑い報告基準について、従前の、症状として「アナフィ
ラキシー」「その他」、その報告期間としてそれぞれ「4 時間」「予防接種との関連
性が高いと医師が認める期間」からの変更の必要性について審議し、引き続き基準に
変更なく新型コロナワクチンに適用されることが了承された。
第7回
R3.5.24 クロザピンの無顆粒球症等に係る血液モニタリング及び再投与
○
血液モニタリング頻度、再投与検討基準等の見直しが行われ、以下の使用上の注意
の改訂及び CPMS 運用手順の変更が了承された。
○
使用上の注意の改訂
・「重要な基本的注意」の項に、52 週以降は4週に1回の血液検査とすることが可能で
4