よむ、つかう、まなぶ。
参考資料13 Vaccines and Related Biological Products Advisory Committee June 7, 2022 Meeting Presentation - FDA Review of Effectiveness and Safety of Novavax COVID-19 Vaccine in Adults > 18 Years of Age - Emergency Use Authorization Request(Vaccines and Related Biological Products Advisory Committee June 7, 2022 Meeting FDA提出資料) (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00043.html |
| 出典情報 | 第80回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第5回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(6/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
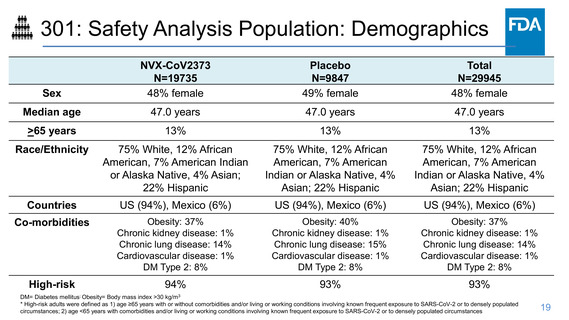
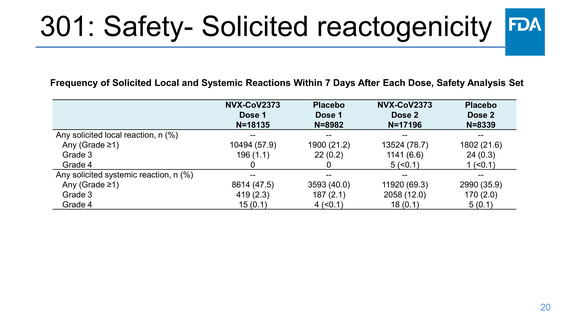
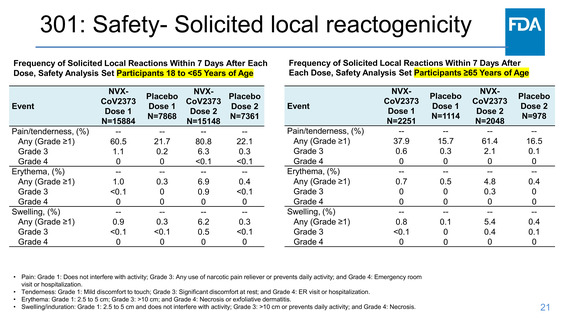
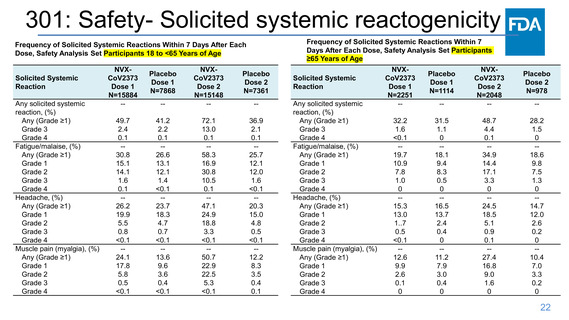
301: Efficacy Endpoints
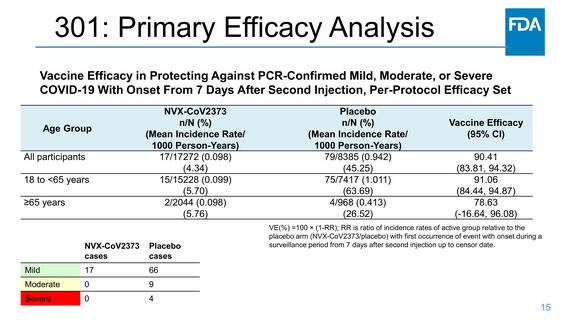
Primary Efficacy Analysis Endpoint
First episode of PCR-confirmed mild,
moderate, or severe COVID-19 with
onset >7 days after Dose 2
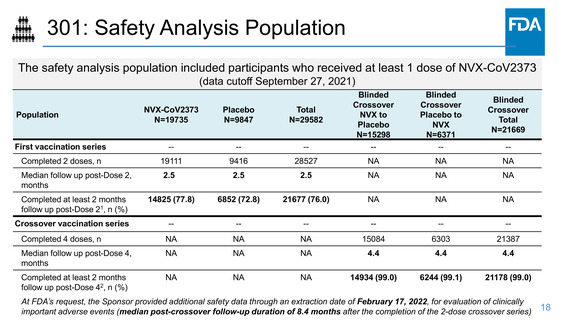
(data from up to the blinded crossover period)
Statistical success criteria
Point estimate of vaccine efficacy
(VE) ≥50% efficacy AND lower
bound of 95% CI >30%
(relative risk ≤70%)
Secondary or Exploratory Efficacy Endpoints
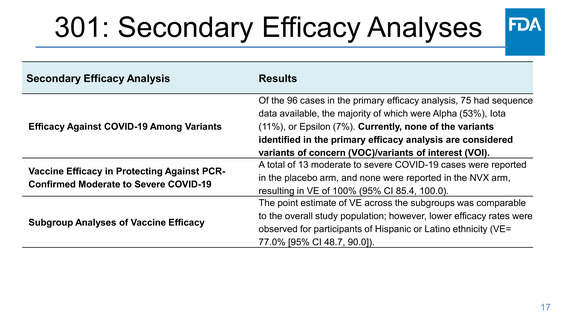
First episode of PCR-confirmed COVID-19, as defined in the primary endpoint, by gene
sequencing to represent a variant not considered as a “variant of concern / interest”
according to the CDC Variants Classification
First episode of PCR-confirmed moderate or severe COVID-19, as defined in the primary
endpoint
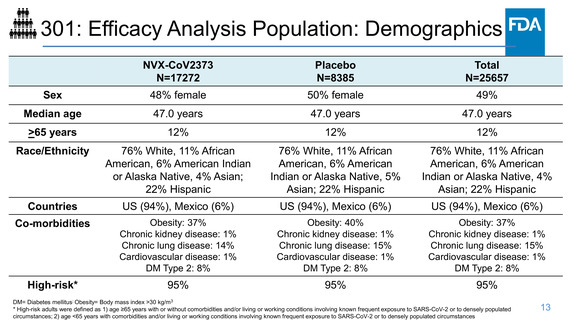
VE according to race and ethnicity
8
Primary Efficacy Analysis Endpoint
First episode of PCR-confirmed mild,
moderate, or severe COVID-19 with
onset >7 days after Dose 2
(data from up to the blinded crossover period)
Statistical success criteria
Point estimate of vaccine efficacy
(VE) ≥50% efficacy AND lower
bound of 95% CI >30%
(relative risk ≤70%)
Secondary or Exploratory Efficacy Endpoints
First episode of PCR-confirmed COVID-19, as defined in the primary endpoint, by gene
sequencing to represent a variant not considered as a “variant of concern / interest”
according to the CDC Variants Classification
First episode of PCR-confirmed moderate or severe COVID-19, as defined in the primary
endpoint
VE according to race and ethnicity
8