よむ、つかう、まなぶ。
総-3参考2 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_67369.html |
| 出典情報 | 中央社会保険医療協議会 総会(第636回 12/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【安全性】
① 国際共同第Ⅰ/Ⅲ相試験(IMpower133 試験)
有害事象は本剤群の 198/198 例(100.0%)
、プラセボ群の 189/196 例(96.4%)に認めら
れ、治験薬との因果関係が否定できない有害事象は本剤群 188/198 例(94.9%)、プラセボ群
181/196 例(92.3%)に認められた。発現率が 5%以上の本剤との因果関係が否定できない有
害事象は表 1 のとおりであった。
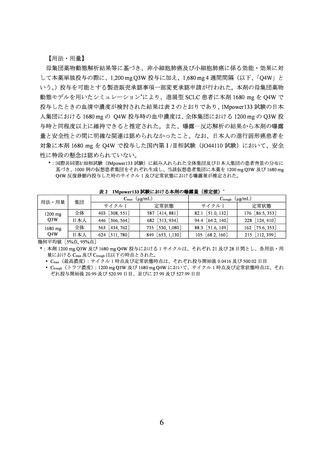
表1
発現率が 5%以上の本剤との因果関係が否定できない有害事象
(IMpower133 試験)
(安全性解析対象集団)
器官別大分類(SOC: System Organ Class)
本剤群(198 例)
基本語(PT: Preferred Term)
全 Grade
Grade 3-4
(MedDRA ver.21.0)
例数(%)
例数(%)
128 (64.6)
51 (25.8)
本剤との因果関係が否定できない全有害事象
37 (18.7)
5 (2.5)
胃腸障害
18 (9.1)
0
悪心
12 (6.1)
4 (2.0)
下痢
12 (6.1)
1 (0.5)
便秘
26 (13.1)
14 ( 7.1)
血液およびリンパ系障害
17 (8.6)
5 (2.5)
貧血
13 (6.6)
11 (5.6)
好中球減少症
24 (12.1)
2 (1.0)
一般・全身障害および投与部位の状態
24
(12.1)
2 (1.0)
疲労
23
(11.6)
0
内分泌障害
18 (9.1)
0
甲状腺機能低下症
10 (5.1)
0
甲状腺機能亢進症
22 (11.1)
1 (0.5)
代謝および栄養障害
22 (11.1)
1 (0.5)
食欲減退
22 (11.1)
0
皮膚および皮下組織障害
12 (6.1)
0
発疹
11 (5.6)
0
脱毛症
16 (8.1)
9 (4.5)
臨床検査
11 (5.6)
2 (1.0)
血小板数減少
10 (5.1)
8 (4.0)
好中球数減少
10 (5.1)
4 (2.0)
傷害、中毒および処置合併症
10 (5.1)
4 (2.0)
注入に伴う反応
Grade 5
例数(%)
1(0.5)
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
なお、本剤群において間質性肺疾患 3 例(1.5%)
、肝機能障害 5 例(2.5%)、大腸炎・重度
の下痢 6 例(3.0%)
、膵炎 1 例(0.5%)
、甲状腺機能障害 26 例(13.1%)
、神経障害(ギラン・
バレー症候群等を含む)9 例(4.5%)
、infusion reaction 11 例(5.6%)
、筋炎・横紋筋融解症 1
例(0.5%)、腎機能障害(尿細管間質性腎炎等)3 例(1.5%)
、重度の皮膚障害 6 例(3.0%)
及び好中球減少・発熱性好中球減少症 24 例(12.1%)が認められた。また、1 型糖尿病、副腎
機能障害、下垂体機能障害、重症筋無力症、脳炎・髄膜炎、心筋炎、溶血性貧血及び免疫性血
小板減少症は認められなかった。本副作用発現状況は関連事象(臨床検査値異常を含む)を
含む集計結果を示す。
5
① 国際共同第Ⅰ/Ⅲ相試験(IMpower133 試験)
有害事象は本剤群の 198/198 例(100.0%)
、プラセボ群の 189/196 例(96.4%)に認めら
れ、治験薬との因果関係が否定できない有害事象は本剤群 188/198 例(94.9%)、プラセボ群
181/196 例(92.3%)に認められた。発現率が 5%以上の本剤との因果関係が否定できない有
害事象は表 1 のとおりであった。
表1
発現率が 5%以上の本剤との因果関係が否定できない有害事象
(IMpower133 試験)
(安全性解析対象集団)
器官別大分類(SOC: System Organ Class)
本剤群(198 例)
基本語(PT: Preferred Term)
全 Grade
Grade 3-4
(MedDRA ver.21.0)
例数(%)
例数(%)
128 (64.6)
51 (25.8)
本剤との因果関係が否定できない全有害事象
37 (18.7)
5 (2.5)
胃腸障害
18 (9.1)
0
悪心
12 (6.1)
4 (2.0)
下痢
12 (6.1)
1 (0.5)
便秘
26 (13.1)
14 ( 7.1)
血液およびリンパ系障害
17 (8.6)
5 (2.5)
貧血
13 (6.6)
11 (5.6)
好中球減少症
24 (12.1)
2 (1.0)
一般・全身障害および投与部位の状態
24
(12.1)
2 (1.0)
疲労
23
(11.6)
0
内分泌障害
18 (9.1)
0
甲状腺機能低下症
10 (5.1)
0
甲状腺機能亢進症
22 (11.1)
1 (0.5)
代謝および栄養障害
22 (11.1)
1 (0.5)
食欲減退
22 (11.1)
0
皮膚および皮下組織障害
12 (6.1)
0
発疹
11 (5.6)
0
脱毛症
16 (8.1)
9 (4.5)
臨床検査
11 (5.6)
2 (1.0)
血小板数減少
10 (5.1)
8 (4.0)
好中球数減少
10 (5.1)
4 (2.0)
傷害、中毒および処置合併症
10 (5.1)
4 (2.0)
注入に伴う反応
Grade 5
例数(%)
1(0.5)
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
0
なお、本剤群において間質性肺疾患 3 例(1.5%)
、肝機能障害 5 例(2.5%)、大腸炎・重度
の下痢 6 例(3.0%)
、膵炎 1 例(0.5%)
、甲状腺機能障害 26 例(13.1%)
、神経障害(ギラン・
バレー症候群等を含む)9 例(4.5%)
、infusion reaction 11 例(5.6%)
、筋炎・横紋筋融解症 1
例(0.5%)、腎機能障害(尿細管間質性腎炎等)3 例(1.5%)
、重度の皮膚障害 6 例(3.0%)
及び好中球減少・発熱性好中球減少症 24 例(12.1%)が認められた。また、1 型糖尿病、副腎
機能障害、下垂体機能障害、重症筋無力症、脳炎・髄膜炎、心筋炎、溶血性貧血及び免疫性血
小板減少症は認められなかった。本副作用発現状況は関連事象(臨床検査値異常を含む)を
含む集計結果を示す。
5