よむ、つかう、まなぶ。
資料7-4 企業から提出された開発工程表の概要等(第Ⅱ回要望) [298KB] (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00044.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第66回 12/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
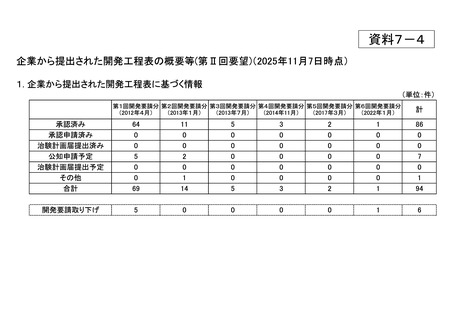
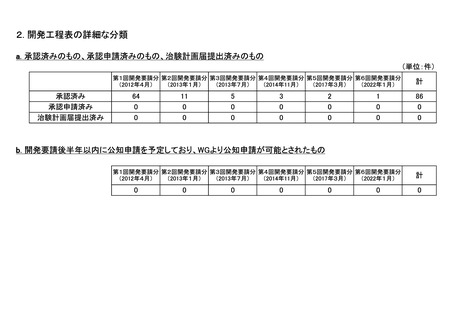
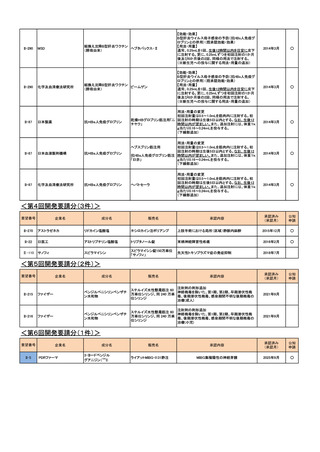
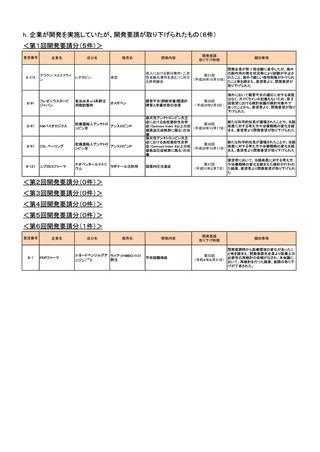
h. 企業が開発を実施していたが、開発要請が取り下げられたもの(6件)
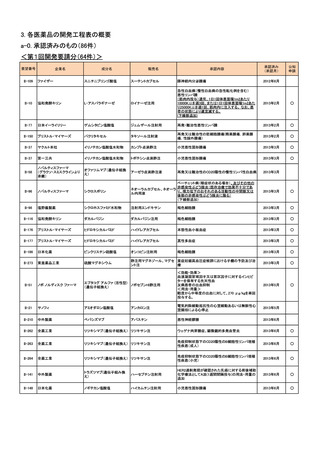
<第1回開発要請分(5件)>
要望番号
II-274
企業名
グラクソ・スミスクライ
ン
成分名
レチガビン
販売名
未定
魚油由来ω3系静注
用脂肪製剤
II-67
KMバイオロジクス
乾燥濃縮人アンチトロ
アンスロビンP
ンビンⅢ
II-67
CSL ベーリング
乾燥濃縮人アンチトロ
アンスロビンP
ンビンⅢ
ニプロESファーマ
チオペンタールナトリ
ウム
II-127
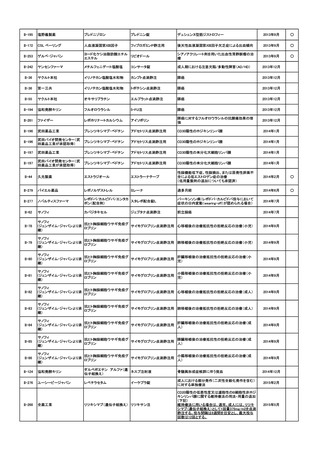
開発要請
取り下げ時期
個別事情
開発企業が第Ⅰ相治験に着手したが、海外
成人における部分発作(二次
の副作用の発生状況等により試験が中止さ
第21回
性全般化発作を含む)に対す
れたこと、海外で厳しい使用制限がかけられ
(平成26年10月10日)
る併用療法
たこと等を踏まえ、要望者より、開発要望が
取り下げられた
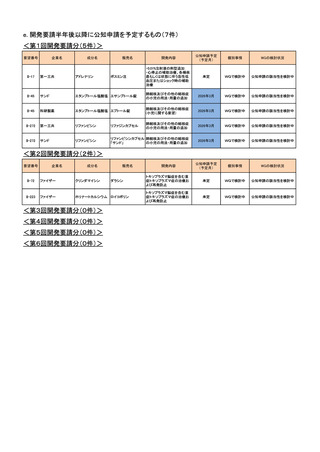
フレゼニウスカービ
ジャパン
II-91
開発内容
オメガベン
ラボナール注射用
腸管不全(静脈栄養)関連肝
障害と栄養状態の改善
第26回
(平成28年2月3日)
海外において腸管不全の適応に対する承認
はなく、ガイドラインの記載もないため、第Ⅱ
回要望における検討会議の検討対象外で
あったことから、要望者より、開発要望が取り
下げられた
後天性アンチトロンビン欠乏
新たな科学的知見が蓄積されたことや、当該
症における血栓塞栓性合併
第36回
疾患に対する考え方や治療戦略の変化を踏
症(Gestosis Index 6以上の妊
(平成30年10月17日)
まえ、要望者より開発要望が取り下げられた
娠高血圧症候群に限る)の治
療
後天性アンチトロンビン欠乏
新たな科学的知見が蓄積されたことや、当該
症における血栓塞栓性合併
第36回
疾患に対する考え方や治療戦略の変化を踏
症(Gestosis Index 6以上の妊
(平成30年10月17日)
まえ、要望者より開発要望が取り下げられた
娠高血圧症候群に限る)の治
療
頭蓋内圧亢進症
要望者において、当該疾患に対する考え方
第37回
や治療戦略の変化を踏まえた検討が行われ
(平成31年2月7日) た結果、要望者より開発要望が取り下げられ
た
<第2回開発要請分(0件)>
<第3回開発要請分(0件)>
<第4回開発要請分(0件)>
<第5回開発要請分(0件)>
<第6回開発要請分(1件)>
要望番号
II-7
企業名
PDRファーマ
成分名
販売名
3-ヨードベンジルグア ライアットMIBG-I131
静注
ニジン(131I)
開発内容
甲状腺髄様癌
開発要請
取り下げ時期
個別事情
開発要請時から医療環境の変化があったこ
と等を踏まえ、開発要請先企業より医療上の
第52回
必要性の再検討の依頼がなされ、本会議に
(令和4年8月31日)
おいて、再検討を行った結果、要請の取り下
げが了承された。
<第1回開発要請分(5件)>
要望番号
II-274
企業名
グラクソ・スミスクライ
ン
成分名
レチガビン
販売名
未定
魚油由来ω3系静注
用脂肪製剤
II-67
KMバイオロジクス
乾燥濃縮人アンチトロ
アンスロビンP
ンビンⅢ
II-67
CSL ベーリング
乾燥濃縮人アンチトロ
アンスロビンP
ンビンⅢ
ニプロESファーマ
チオペンタールナトリ
ウム
II-127
開発要請
取り下げ時期
個別事情
開発企業が第Ⅰ相治験に着手したが、海外
成人における部分発作(二次
の副作用の発生状況等により試験が中止さ
第21回
性全般化発作を含む)に対す
れたこと、海外で厳しい使用制限がかけられ
(平成26年10月10日)
る併用療法
たこと等を踏まえ、要望者より、開発要望が
取り下げられた
フレゼニウスカービ
ジャパン
II-91
開発内容
オメガベン
ラボナール注射用
腸管不全(静脈栄養)関連肝
障害と栄養状態の改善
第26回
(平成28年2月3日)
海外において腸管不全の適応に対する承認
はなく、ガイドラインの記載もないため、第Ⅱ
回要望における検討会議の検討対象外で
あったことから、要望者より、開発要望が取り
下げられた
後天性アンチトロンビン欠乏
新たな科学的知見が蓄積されたことや、当該
症における血栓塞栓性合併
第36回
疾患に対する考え方や治療戦略の変化を踏
症(Gestosis Index 6以上の妊
(平成30年10月17日)
まえ、要望者より開発要望が取り下げられた
娠高血圧症候群に限る)の治
療
後天性アンチトロンビン欠乏
新たな科学的知見が蓄積されたことや、当該
症における血栓塞栓性合併
第36回
疾患に対する考え方や治療戦略の変化を踏
症(Gestosis Index 6以上の妊
(平成30年10月17日)
まえ、要望者より開発要望が取り下げられた
娠高血圧症候群に限る)の治
療
頭蓋内圧亢進症
要望者において、当該疾患に対する考え方
第37回
や治療戦略の変化を踏まえた検討が行われ
(平成31年2月7日) た結果、要望者より開発要望が取り下げられ
た
<第2回開発要請分(0件)>
<第3回開発要請分(0件)>
<第4回開発要請分(0件)>
<第5回開発要請分(0件)>
<第6回開発要請分(1件)>
要望番号
II-7
企業名
PDRファーマ
成分名
販売名
3-ヨードベンジルグア ライアットMIBG-I131
静注
ニジン(131I)
開発内容
甲状腺髄様癌
開発要請
取り下げ時期
個別事情
開発要請時から医療環境の変化があったこ
と等を踏まえ、開発要請先企業より医療上の
第52回
必要性の再検討の依頼がなされ、本会議に
(令和4年8月31日)
おいて、再検討を行った結果、要請の取り下
げが了承された。