よむ、つかう、まなぶ。
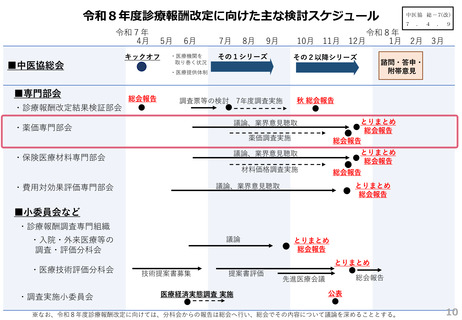
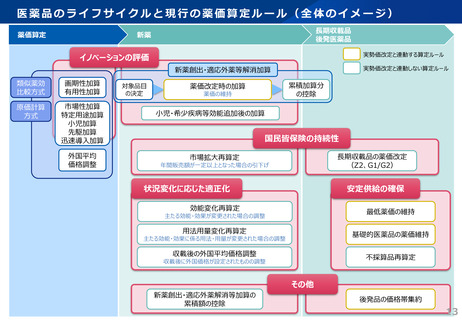
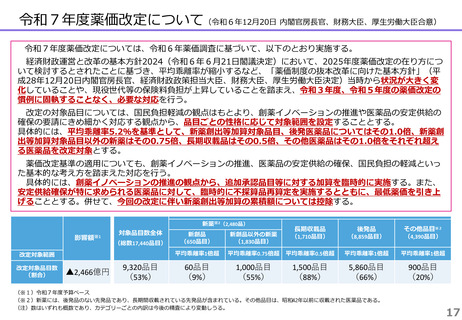
薬-2令和8年度薬価改定について (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58997.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第235回 6/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
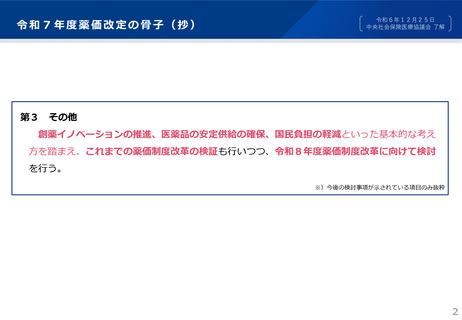
3.より活発な創薬が行われる環境の整備
〔条件付き承認制度の適用拡大/小児用医薬品の開発計画策定の促進〕
概要
●希少・重篤な疾患の治療のため医療上特に必要性が高い医薬品への速やかな患者アクセスを確保するため、条件付き
承認制度を適用する医薬品の拡大を図るとともに、医療用医薬品の承認申請時に小児用医薬品の開発計画の策定を
努力義務とする。
<条件付き承認制度を適用する医薬品の拡大>
見直し後の条件付き承認制度のイメージ
・ 希少で患者数が少ない疾患や重篤かつ代替の治療法がない疾患を対象に、探索的臨床試験等で、一定程度の有効性・安全性が確認さ
れ、臨床的有用性が合理的に予測可能な場合に、承認後に検証的臨床試験等を行うことを条件に承認。
探索的臨床試験
(第Ⅱ相試験)等
承認
市販後安全対策を講じつつ
製造・販売
有効性の検証等
【有効性の検証等ができた場合】
→引き続き、市販後安全対策を講じながら製造、販売
【検証できない場合】
→承認を取り消し
承認取り消しを可能とすること
で、条件付き承認を行いやすい
環境を整え、適用の拡大を図る。
〔探索的臨床試験〕 少数の患者を対象に実施。医薬品等の有効性、安全性を検討し、用法・用量等を設定するために行われる。
〔検証的臨床試験〕 多数の患者を対象に実施。探索的臨床試験を踏まえ設定した用法・用量等での安全性・有効性を検証するために行われる。
【参考】通常の承認制度
探索的臨床試験
(第Ⅱ相試験)等
検証的臨床試験
(第Ⅲ相試験)
承認
市販後安全対策を講じつつ製造・販売
<小児用医薬品の開発計画の策定の努力義務化>
薬局医薬品の製造販売業者に対し、小児用医薬品の開発計画の策定を努力義務とする。
小児用医薬品の開発計画が策定された医薬品の再審査の期間について、すでに上限(10年)で設定されている場合に、上限を2年延長
できることとする。
22
〔条件付き承認制度の適用拡大/小児用医薬品の開発計画策定の促進〕
概要
●希少・重篤な疾患の治療のため医療上特に必要性が高い医薬品への速やかな患者アクセスを確保するため、条件付き
承認制度を適用する医薬品の拡大を図るとともに、医療用医薬品の承認申請時に小児用医薬品の開発計画の策定を
努力義務とする。
<条件付き承認制度を適用する医薬品の拡大>
見直し後の条件付き承認制度のイメージ
・ 希少で患者数が少ない疾患や重篤かつ代替の治療法がない疾患を対象に、探索的臨床試験等で、一定程度の有効性・安全性が確認さ
れ、臨床的有用性が合理的に予測可能な場合に、承認後に検証的臨床試験等を行うことを条件に承認。
探索的臨床試験
(第Ⅱ相試験)等
承認
市販後安全対策を講じつつ
製造・販売
有効性の検証等
【有効性の検証等ができた場合】
→引き続き、市販後安全対策を講じながら製造、販売
【検証できない場合】
→承認を取り消し
承認取り消しを可能とすること
で、条件付き承認を行いやすい
環境を整え、適用の拡大を図る。
〔探索的臨床試験〕 少数の患者を対象に実施。医薬品等の有効性、安全性を検討し、用法・用量等を設定するために行われる。
〔検証的臨床試験〕 多数の患者を対象に実施。探索的臨床試験を踏まえ設定した用法・用量等での安全性・有効性を検証するために行われる。
【参考】通常の承認制度
探索的臨床試験
(第Ⅱ相試験)等
検証的臨床試験
(第Ⅲ相試験)
承認
市販後安全対策を講じつつ製造・販売
<小児用医薬品の開発計画の策定の努力義務化>
薬局医薬品の製造販売業者に対し、小児用医薬品の開発計画の策定を努力義務とする。
小児用医薬品の開発計画が策定された医薬品の再審査の期間について、すでに上限(10年)で設定されている場合に、上限を2年延長
できることとする。
22