よむ、つかう、まなぶ。
総-2 参考[1005KB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58800.html |
| 出典情報 | 中央社会保険医療協議会 総会(第609回 6/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
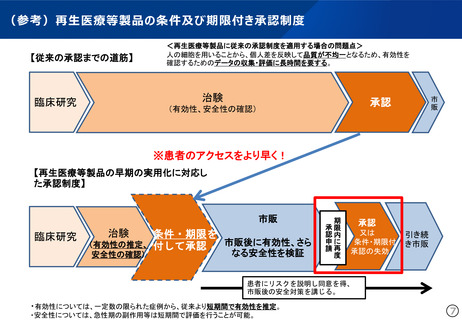
(参考)再生医療等製品の条件及び期限付き承認制度
【従来の承認までの道筋】
<再生医療等製品に従来の承認制度を適用する場合の問題点>
人の細胞を用いることから、個人差を反映して品質が不均一となるため、有効性を
確認するためのデータの収集・評価に長時間を要する。
治験
臨床研究
市
販
承認
(有効性、安全性の確認)
※患者のアクセスをより早く!
【再生医療等製品の早期の実用化に対応し
た承認制度】
市販
臨床研究
治験
条件・期限を
市販後に有効性、さら
(有効性の推定、 付して承認
安全性の確認)
なる安全性を検証
期
承限
認内
申に
請再
度
承認
又は
条件・期限付
承認の失効
引き続
き市販
患者にリスクを説明し同意を得、
市販後の安全対策を講じる。
・有効性については、一定数の限られた症例から、従来より短期間で有効性を推定。
・安全性については、急性期の副作用等は短期間で評価を行うことが可能。
7
【従来の承認までの道筋】
<再生医療等製品に従来の承認制度を適用する場合の問題点>
人の細胞を用いることから、個人差を反映して品質が不均一となるため、有効性を
確認するためのデータの収集・評価に長時間を要する。
治験
臨床研究
市
販
承認
(有効性、安全性の確認)
※患者のアクセスをより早く!
【再生医療等製品の早期の実用化に対応し
た承認制度】
市販
臨床研究
治験
条件・期限を
市販後に有効性、さら
(有効性の推定、 付して承認
安全性の確認)
なる安全性を検証
期
承限
認内
申に
請再
度
承認
又は
条件・期限付
承認の失効
引き続
き市販
患者にリスクを説明し同意を得、
市販後の安全対策を講じる。
・有効性については、一定数の限られた症例から、従来より短期間で有効性を推定。
・安全性については、急性期の副作用等は短期間で評価を行うことが可能。
7