よむ、つかう、まなぶ。
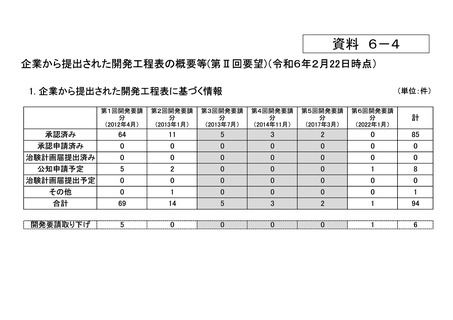
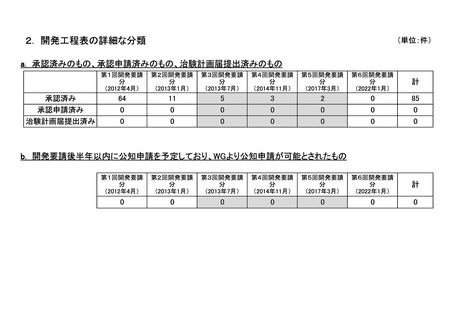
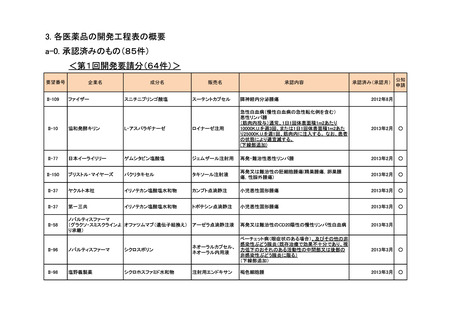
資料6-4 企業から提出された開発工程表の概要等(第II回要望) (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00032.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第58回 3/21)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
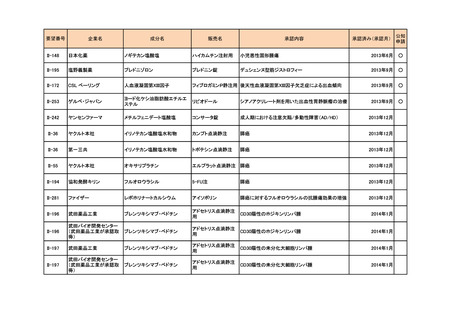
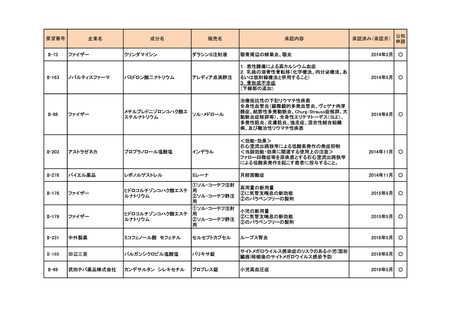
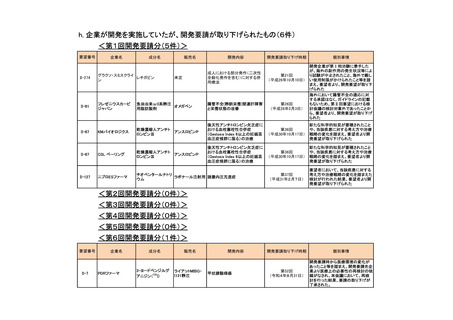
要望番号
II-87
企業名
化学及血清療法研究所
成分名
抗HBs人免疫グロブリン
販売名
ヘパトセーラ
承認内容
用法・用量の変更
初回注射量は0.5~1.0mLを筋肉内に注射する。初回
注射の時期は生後5日以内とする。なお、生後12時間
以内が望ましい。また、追加注射には、体重1kg当た
り0.16~0.24mLを投与する。
(下線部追加)
承認済み(承認月)
公知
申請
2014年3月
○
承認済み(承認月)
公知
申請
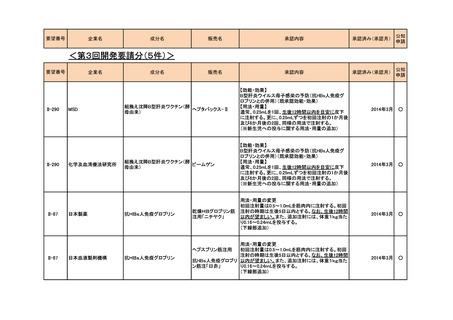
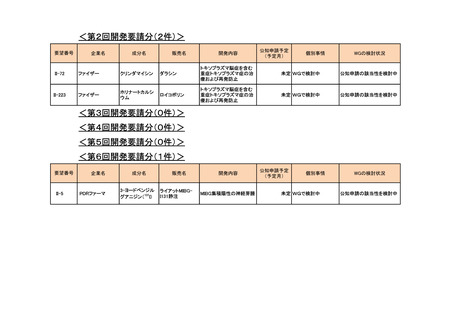
<第4回開発要請分(3件)>
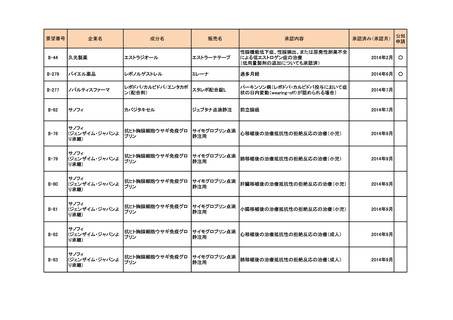
要望番号
企業名
成分名
販売名
承認内容
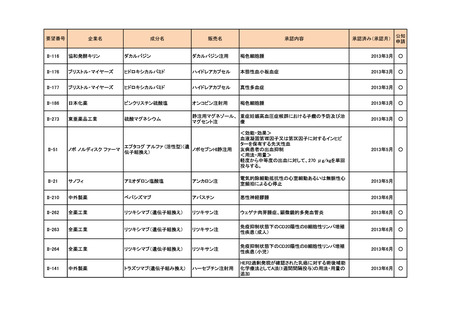
II-270
アストラゼネカ
リドカイン塩酸塩
キシロカイン注ポリア
ンプ
上肢手術における局所(区域)静脈内麻酔
2015年12月
○
II-22
日医工
アミトリプチリン塩酸塩
トリプタノール錠
末梢神経障害性疼痛
2016年2月
○
Ⅱ-110
サノフィ
スピラマイシン
スピラマイシン錠150
万単位「サノフィ」
先天性トキソプラズマ症の発症抑制
2018年7月
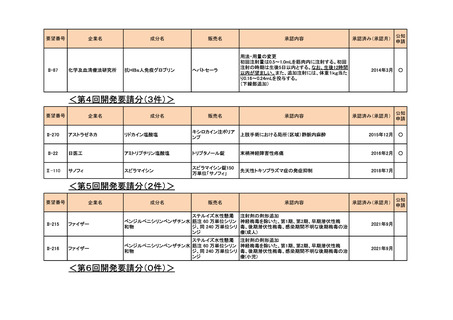
<第5回開発要請分(2件)>
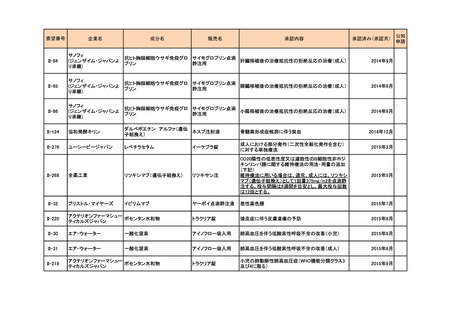
要望番号
II-215
II-216
企業名
成分名
販売名
承認内容
承認済み(承認月)
ファイザー
ステルイズ水性懸濁 注射剤の剤形追加
ベンジルペニシリンベンザチン水 筋注 60 万単位シリン 神経梅毒を除いた、第1期、第2期、早期潜伏性梅
和物
ジ、同 240 万単位シリ 毒、後期潜伏性梅毒、感染期間不明な後期梅毒の治
ンジ
療(成人)
2021年9月
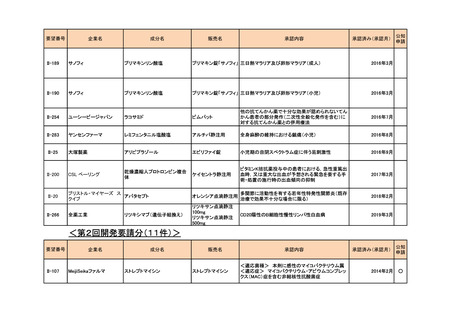
ファイザー
ステルイズ水性懸濁 注射剤の剤形追加
ベンジルペニシリンベンザチン水 筋注 60 万単位シリン 神経梅毒を除いた、第1期、第2期、早期潜伏性梅
和物
ジ、同 240 万単位シリ 毒、後期潜伏性梅毒、感染期間不明な後期梅毒の治
ンジ
療(小児)
2021年9月
公知
申請
<第6回開発要請分(0件)>
149 / 213
II-87
企業名
化学及血清療法研究所
成分名
抗HBs人免疫グロブリン
販売名
ヘパトセーラ
承認内容
用法・用量の変更
初回注射量は0.5~1.0mLを筋肉内に注射する。初回
注射の時期は生後5日以内とする。なお、生後12時間
以内が望ましい。また、追加注射には、体重1kg当た
り0.16~0.24mLを投与する。
(下線部追加)
承認済み(承認月)
公知
申請
2014年3月
○
承認済み(承認月)
公知
申請
<第4回開発要請分(3件)>
要望番号
企業名
成分名
販売名
承認内容
II-270
アストラゼネカ
リドカイン塩酸塩
キシロカイン注ポリア
ンプ
上肢手術における局所(区域)静脈内麻酔
2015年12月
○
II-22
日医工
アミトリプチリン塩酸塩
トリプタノール錠
末梢神経障害性疼痛
2016年2月
○
Ⅱ-110
サノフィ
スピラマイシン
スピラマイシン錠150
万単位「サノフィ」
先天性トキソプラズマ症の発症抑制
2018年7月
<第5回開発要請分(2件)>
要望番号
II-215
II-216
企業名
成分名
販売名
承認内容
承認済み(承認月)
ファイザー
ステルイズ水性懸濁 注射剤の剤形追加
ベンジルペニシリンベンザチン水 筋注 60 万単位シリン 神経梅毒を除いた、第1期、第2期、早期潜伏性梅
和物
ジ、同 240 万単位シリ 毒、後期潜伏性梅毒、感染期間不明な後期梅毒の治
ンジ
療(成人)
2021年9月
ファイザー
ステルイズ水性懸濁 注射剤の剤形追加
ベンジルペニシリンベンザチン水 筋注 60 万単位シリン 神経梅毒を除いた、第1期、第2期、早期潜伏性梅
和物
ジ、同 240 万単位シリ 毒、後期潜伏性梅毒、感染期間不明な後期梅毒の治
ンジ
療(小児)
2021年9月
公知
申請
<第6回開発要請分(0件)>
149 / 213