よむ、つかう、まなぶ。
資料No.2~2-1_日本薬局方の参考情報の改正(案)について (30 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00008.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和5年度第1回 1/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
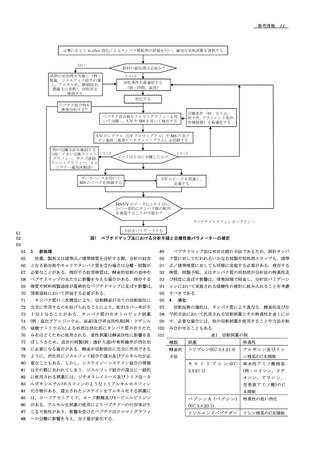
18 参考情報 .
1
4.2.
細胞応答の評価
50
解析は,タンパク質医薬品の不溶性微粒子の評価方法として有
2
細胞刺激に伴う細胞応答として細胞表面マーカー分子の発現
51
用と考えられる.本参考情報では主に,タンパク質医薬品注射
3
量の増加や減少が認められる場合,フローサイトメトリーによ
52
剤などバイオ医薬品に含まれる不溶性微粒子の評価法について
4
って定量的に発現変動を解析することができる.受容体を介し
53
記載する.
5
た細胞応答を誘導するホルモン・サイトカイン類のほか,細胞
54
1.
6
応答を促す液性因子やその受容体を標的とする中和抗体の生物
55
装置は,一般に,試料導入部,画像を取得する領域であるフ
7
活性評価にも使用される.試料を添加して一定時間培養する等
56
ローセル,各部位をつなぐ流路,ポンプ(チューブポンプやシ
8
の処理を施した細胞をマーカー分子に対する蛍光標識抗体を用
57
リンジポンプ),光源を含む光学系,撮像装置であるカメラ及
9
いて染色し,マーカー分子の発現する細胞の割合や,発現量を
58
び取得した画像を解析する画像解析装置などからなる.フロー
10
測定する.
59
セルに流れてきた試料溶液に光源より光が照射され,撮像装置
11
4.3.
60
により画像が取得される.測定可能な粒子径はフローセルの厚
12
フローサイトメトリーは,生物活性試験に用いる細胞における
61
さと対物レンズの倍率,カメラの性能などにより規定され,多
13
受容体などの標的タンパク質の発現確認のための有用な手法
62
くの場合,測定範囲は約2 ~ 100 μm程度である.粒子画像デ
14
の一つである.培養細胞はクローン化された株化細胞であっ
63
ータは画像解析装置によって処理され,例えば画像の背景部分
15
ても不均一な遺伝子発現パターンを示すことがあり,培養期
64
と粒子部分の濃淡に基づいて画像中の粒子の境界が認識され,
16
間の経過により形質が変化する可能性がある.また,標的タ
65
粒子個々の形状及び光学的特性の評価が行われる.微粒子の計
17
ンパク質を発現させるために遺伝子導入により作製した細胞
66
数値を測定体積で除することで粒子濃度が求められる.
18
株では,導入遺伝子の欠落やサイレンシングによる標的タン
67
2.
19
パク質の発現の消失や低下が生じる可能性について考慮する
68
2.1.
20
必要がある.標的タンパク質に対する蛍光標識抗体を用いた
69
測定は,一般に次の手順で行われる.対物レンズの倍率は測
21
染色により,標的タンパク質の発現割合や発現量を測定し,
70
定する粒子の大きさに応じたものを使用し,通常,4 ~ 20倍
22
あらかじめ定めた基準に適合することを確認する.
71
の対物レンズが使用される.測定前に,フローセルを洗浄し,
72
フローセル内にとどまっている粒子がないことを確認する.な
73
お,セルの洗浄には微粒子を含まない水の他,必要に応じて洗
にフローイメージング法に
74
剤や薄めた水酸化ナトリウム溶液,エタノールなどを使用でき
24
よるバイオテクノロジー応用医薬品(バイオ医薬品)原薬/製剤
75
る.その後,装置の使用手順に定められた方法にて焦点を適切
25
中の不溶性微粒子の評価法
76
に合わせる.装置ごとに必要な測定条件(流量,測定容量,画
77
像取得頻度,背景から粒子を区別するための閾値など)を設定
78
する.フローセルに導入された溶液のうち実際に画像解析され
79
た割合を画像取得効率という.画像取得効率を設定できる装置
80
の場合,画像取得効率は,測定容量,流量,画像取得頻度から
81
算出され[画像取得効率=画像取得頻度(frames/s)×画像一枚当
82
たりの測定容量(mL/frame)/流量(mL/s)×100 (%)],同じ粒
子が複数回計数されないように,また,実際に測定される容量
23
26
27
28
生物活性試験に用いる培養細胞の適格性評価
参考情報
G3.
生物薬品関連
を加える.
フローイメージング法によるバイオテクノロ
ジー応用医薬品(バイオ医薬品)原薬/製剤中
の不溶性微粒子の評価法〈G3-17-182〉
測定の原理
測定
装置
29
バイオテクノロジー応用医薬品(以下「バイオ医薬品」とい
30
う.)には,外来性の物質,製造工程に由来する物質及び処方
83
31
成分や一次容器からの溶出物に加えて,タンパク質それ自身が
84
が十分となるよう,適切に設定する.測定領域を設定できる場
32
凝集してできたタンパク質凝集体などの不溶性微粒子が含まれ
85
合,計数の正確性は,計数標準粒子を測定することにより確認
33
る可能性がある.注射剤に含まれる微粒子を評価・管理するこ
86
できる.さらに,測定の原理上,粒子の一部が測定領域に収ま
34
とは,最終製品の品質を確保する上で重要であるが,タンパク
87
らず,一部が欠けた粒子画像が得られることが想定される.部
35
質凝集体については,タンパク質製剤の免疫原性に影響する可
88
分的に撮像された粒子の取扱いについては事前に設定しておく.
36
能性が懸念されており,より厳密な評価・管理が求められる.
89
2.2.
37
フローイメージング法は,試料溶液をフローセルに導入し,
90
試験は外部から微粒子が混入しない条件下,できれば層流等
38
連続的に画像を撮影し,得られたデジタル画像を数値情報に変
91
により清浄度の保たれたキャビネット中で行う.試料は,含ま
39
換して解析することにより,溶液に含まれる微粒子の計数,粒
92
れる粒子が均一になるように,例えば容器をゆっくりと旋回さ
40
子径分布の測定,形状及び光学的特性の評価を行う手法である.
93
せるなど,穏やかに十分に振り混ぜる.容器を開封する際には,
41
光遮蔽粒子計数法では屈折率の高いポリスチレン標準粒子を用
94
必要に応じて容器開口部の外表面を微粒子試験用水で洗浄し,
42
いて得られた粒径応答曲線により粒子径が算出されるため,水
95
内部が汚染されないよう注意して栓を開ける.溶液中に存在す
43
との屈折率の差が小さいタンパク質凝集体は検出されないか小
96
る微粒子を測定するにあたり,操作中に気泡や新たな凝集を引
44
さく検出される恐れがある.一方でフローイメージング法は光
97
き起こさないように注意が必要である.必要に応じて,気泡を
45
遮蔽粒子計数法と比較して,溶媒と粒子との屈折率差の影響を
98
除くために,容器を大気圧下にしばらく放置する,又は減圧し
46
受けづらいことが示されている.また,形状及び光学的特性を
99
て放置する.超音波処理はタンパク質を凝集,変性させるおそ
47
評価することにより,タンパク質凝集体,シリコーン油,気泡
100
れがあることから,適切ではない.装置に導入する試料の液量
48
及びその他の不溶性微粒子を区別できる場合もある.フローイ
101
は,測定容量と風袋容量を考慮して決定する.測定容量は,試
49
メージング法による粒子数の定量的評価や含まれる粒子の特性
102
料の特性,画像取得効率及び求める分析法の精度等を考慮して
103
十分な容量とする.試料の粘度が高い,粒子数が多いなど,必
操作法
1
4.2.
細胞応答の評価
50
解析は,タンパク質医薬品の不溶性微粒子の評価方法として有
2
細胞刺激に伴う細胞応答として細胞表面マーカー分子の発現
51
用と考えられる.本参考情報では主に,タンパク質医薬品注射
3
量の増加や減少が認められる場合,フローサイトメトリーによ
52
剤などバイオ医薬品に含まれる不溶性微粒子の評価法について
4
って定量的に発現変動を解析することができる.受容体を介し
53
記載する.
5
た細胞応答を誘導するホルモン・サイトカイン類のほか,細胞
54
1.
6
応答を促す液性因子やその受容体を標的とする中和抗体の生物
55
装置は,一般に,試料導入部,画像を取得する領域であるフ
7
活性評価にも使用される.試料を添加して一定時間培養する等
56
ローセル,各部位をつなぐ流路,ポンプ(チューブポンプやシ
8
の処理を施した細胞をマーカー分子に対する蛍光標識抗体を用
57
リンジポンプ),光源を含む光学系,撮像装置であるカメラ及
9
いて染色し,マーカー分子の発現する細胞の割合や,発現量を
58
び取得した画像を解析する画像解析装置などからなる.フロー
10
測定する.
59
セルに流れてきた試料溶液に光源より光が照射され,撮像装置
11
4.3.
60
により画像が取得される.測定可能な粒子径はフローセルの厚
12
フローサイトメトリーは,生物活性試験に用いる細胞における
61
さと対物レンズの倍率,カメラの性能などにより規定され,多
13
受容体などの標的タンパク質の発現確認のための有用な手法
62
くの場合,測定範囲は約2 ~ 100 μm程度である.粒子画像デ
14
の一つである.培養細胞はクローン化された株化細胞であっ
63
ータは画像解析装置によって処理され,例えば画像の背景部分
15
ても不均一な遺伝子発現パターンを示すことがあり,培養期
64
と粒子部分の濃淡に基づいて画像中の粒子の境界が認識され,
16
間の経過により形質が変化する可能性がある.また,標的タ
65
粒子個々の形状及び光学的特性の評価が行われる.微粒子の計
17
ンパク質を発現させるために遺伝子導入により作製した細胞
66
数値を測定体積で除することで粒子濃度が求められる.
18
株では,導入遺伝子の欠落やサイレンシングによる標的タン
67
2.
19
パク質の発現の消失や低下が生じる可能性について考慮する
68
2.1.
20
必要がある.標的タンパク質に対する蛍光標識抗体を用いた
69
測定は,一般に次の手順で行われる.対物レンズの倍率は測
21
染色により,標的タンパク質の発現割合や発現量を測定し,
70
定する粒子の大きさに応じたものを使用し,通常,4 ~ 20倍
22
あらかじめ定めた基準に適合することを確認する.
71
の対物レンズが使用される.測定前に,フローセルを洗浄し,
72
フローセル内にとどまっている粒子がないことを確認する.な
73
お,セルの洗浄には微粒子を含まない水の他,必要に応じて洗
にフローイメージング法に
74
剤や薄めた水酸化ナトリウム溶液,エタノールなどを使用でき
24
よるバイオテクノロジー応用医薬品(バイオ医薬品)原薬/製剤
75
る.その後,装置の使用手順に定められた方法にて焦点を適切
25
中の不溶性微粒子の評価法
76
に合わせる.装置ごとに必要な測定条件(流量,測定容量,画
77
像取得頻度,背景から粒子を区別するための閾値など)を設定
78
する.フローセルに導入された溶液のうち実際に画像解析され
79
た割合を画像取得効率という.画像取得効率を設定できる装置
80
の場合,画像取得効率は,測定容量,流量,画像取得頻度から
81
算出され[画像取得効率=画像取得頻度(frames/s)×画像一枚当
82
たりの測定容量(mL/frame)/流量(mL/s)×100 (%)],同じ粒
子が複数回計数されないように,また,実際に測定される容量
23
26
27
28
生物活性試験に用いる培養細胞の適格性評価
参考情報
G3.
生物薬品関連
を加える.
フローイメージング法によるバイオテクノロ
ジー応用医薬品(バイオ医薬品)原薬/製剤中
の不溶性微粒子の評価法〈G3-17-182〉
測定の原理
測定
装置
29
バイオテクノロジー応用医薬品(以下「バイオ医薬品」とい
30
う.)には,外来性の物質,製造工程に由来する物質及び処方
83
31
成分や一次容器からの溶出物に加えて,タンパク質それ自身が
84
が十分となるよう,適切に設定する.測定領域を設定できる場
32
凝集してできたタンパク質凝集体などの不溶性微粒子が含まれ
85
合,計数の正確性は,計数標準粒子を測定することにより確認
33
る可能性がある.注射剤に含まれる微粒子を評価・管理するこ
86
できる.さらに,測定の原理上,粒子の一部が測定領域に収ま
34
とは,最終製品の品質を確保する上で重要であるが,タンパク
87
らず,一部が欠けた粒子画像が得られることが想定される.部
35
質凝集体については,タンパク質製剤の免疫原性に影響する可
88
分的に撮像された粒子の取扱いについては事前に設定しておく.
36
能性が懸念されており,より厳密な評価・管理が求められる.
89
2.2.
37
フローイメージング法は,試料溶液をフローセルに導入し,
90
試験は外部から微粒子が混入しない条件下,できれば層流等
38
連続的に画像を撮影し,得られたデジタル画像を数値情報に変
91
により清浄度の保たれたキャビネット中で行う.試料は,含ま
39
換して解析することにより,溶液に含まれる微粒子の計数,粒
92
れる粒子が均一になるように,例えば容器をゆっくりと旋回さ
40
子径分布の測定,形状及び光学的特性の評価を行う手法である.
93
せるなど,穏やかに十分に振り混ぜる.容器を開封する際には,
41
光遮蔽粒子計数法では屈折率の高いポリスチレン標準粒子を用
94
必要に応じて容器開口部の外表面を微粒子試験用水で洗浄し,
42
いて得られた粒径応答曲線により粒子径が算出されるため,水
95
内部が汚染されないよう注意して栓を開ける.溶液中に存在す
43
との屈折率の差が小さいタンパク質凝集体は検出されないか小
96
る微粒子を測定するにあたり,操作中に気泡や新たな凝集を引
44
さく検出される恐れがある.一方でフローイメージング法は光
97
き起こさないように注意が必要である.必要に応じて,気泡を
45
遮蔽粒子計数法と比較して,溶媒と粒子との屈折率差の影響を
98
除くために,容器を大気圧下にしばらく放置する,又は減圧し
46
受けづらいことが示されている.また,形状及び光学的特性を
99
て放置する.超音波処理はタンパク質を凝集,変性させるおそ
47
評価することにより,タンパク質凝集体,シリコーン油,気泡
100
れがあることから,適切ではない.装置に導入する試料の液量
48
及びその他の不溶性微粒子を区別できる場合もある.フローイ
101
は,測定容量と風袋容量を考慮して決定する.測定容量は,試
49
メージング法による粒子数の定量的評価や含まれる粒子の特性
102
料の特性,画像取得効率及び求める分析法の精度等を考慮して
103
十分な容量とする.試料の粘度が高い,粒子数が多いなど,必
操作法