よむ、つかう、まなぶ。
資料No.2~2-1_日本薬局方の参考情報の改正(案)について (26 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00008.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和5年度第1回 1/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
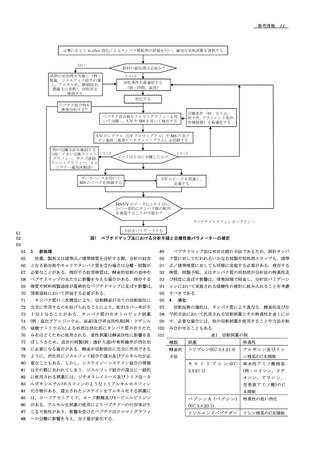
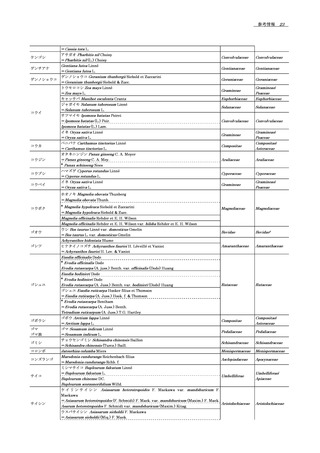
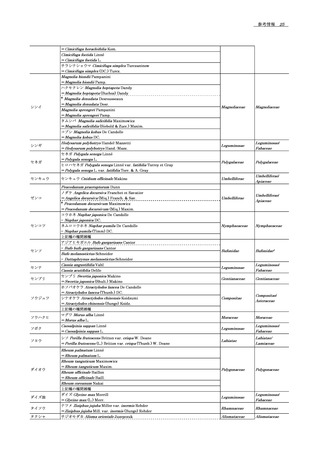
14 参考情報 .
1
マップ法を用いて同定されたアミノ酸配列の割合を指す.全て
55
(5)ピーク高さ/シグナルノイズ比
2
の分析目的に対応する特定の数値は存在しないが,多くの場合
56
(6)ピーク形状
3
95%程度の配列カバー率がペプチドマップ法において許容で
57
(7)ピークの保持時間
4
きる性能の目標である.
58
(8)特定のピークの分解能
5
8.2.
59
試料の分離,精製又は濃縮を必要とする試験方法の手順に対
6
特異的な結合切断
60
しては,試料の回収率の基準を設定すべきであり,システム適
7
合は,同定し,記録する.
61
合性の評価の一部として設定するべきである.消化により生じ
8
8.3.
62
たアーティファクトが認められる場合には,妨害のないことを
63
実証するためにブランク消化試料を評価することが必要となる.
9.
9
選択した酵素又は化学的消化手順により切断される特異的結
主なピーク
特異的な結合の切断により回収された主なペプチドは,同定
10
し,記録する.
64
11
8.4.
バリデーション
65
ペプチドマップ法の手順のバリデーションを実施する前に,
12
部分的又は不完全な切断を生じやすいペプチド結合及び関連
66
試験操作手順は最終化しシステム適合性の基準と一緒に文書化
13
するクロマトグラム上のピークやシグナルは同定する必要があ
67
すべきである.試験を行うたびに,結果をシステム適合性の基
14
る.
68
準で評価し,過去の試験結果と一致する再現性のある結果が得
15
8.5.
69
られているかを判断する.最終化する前は,判定基準がシステ
70
ム適合性の基準によってしばしば変化することがある.分析バ
16
部分的切断
マイナー/非特異的切断
非特異的な結合の切断の程度は同定し,制限又は管理する必
17
要がある.
71
リデーションにおけるプロトコールの要素は次のとおりである.
18
8.6.
72
9.1.
プロテアーゼ由来のピーク
特異性
19
プロテアーゼが試料タンパク質の消化に用いられる場合は,
73
分析性能の要件は,確認試験の目的により異なり,リスクア
20
バックグラウンドに認められるプロテアーゼ由来のピークを同
74
セスメントを行うことにより同一施設で製造されるタンパク質
21
定し,必要に応じて制限する必要がある.
75
医薬品と試料タンパク質を区別するためにどの程度の特異性が
22
8.7.
76
必要かを理解する必要がある.ペプチドマップ法は,試料の一
23
未消化の「コア」タンパク質
77
次構造が参照タンパク質と一致することを確認する相対比較の
24
ア」と呼ばれる)は同定し,制限する必要がある.
78
手法である.特異性は適切な標準品/標準物質と構造の類似し
25
8.8.
79
たタンパク質試料のペプチドマップと比較することにより確認
未消化又は部分的に消化されたタンパク質(しばしば「コ
平均ペプチド長
26
選択したプロテアーゼ又は化学的切断試薬と試料タンパク質
80
される.比較試料は,同一施設で製造される他のタンパク質医
27
の組み合わせにより生成する一連のペプチドを記述する.小さ
81
薬品に関するリスクアセスメントに基づき選択し,バリデーシ
28
なペプチドと大きなペプチドはトレードオフの関係にある.小
82
ョンのプロトコールとして文書化するべきである.試験の本質
29
さなペプチドは,ペプチドマップ法において高い構造選択性を
83
的なばらつきを最小化するために,試験時には標準品/標準物
30
示すが,多くのピークを示す複雑なマップとなる.一方で,長
84
質及び試料タンパク質に対して試験操作を実施する.特異性の
31
いペプチドは構造変異体を分離する能力は低くなるが単純なマ
85
バリデーション試験として試料タンパク質消化物,標準品/標
32
ップが得られる.全ての分析目的に適切な特定のペプチド長は
86
準物質の消化物及び検体並びに標準品/標準物質の消化物の
33
存在しないが,一般的には平均ペプチド長は10 ~ 20残基が適
87
1:1(v/v)混合液を分析することはペプチドマップ法の試験デ
34
切と考えられる.
88
ザインとして有用といえる.試料タンパク質のペプチドマップ
35
8.9.
89
における試料タンパク質のピークと,標準品/標準物質の対応
分解能
36
分解能は,プロテアーゼ又は化学的切断試薬により生成した
90
するピークの保持時間が僅かに異なることにより,分析者がピ
37
一連のペプチドを分離するシステムの能力のことをいう.例え
91
ークは同一ではないと判断することがある.特異性のバリデー
38
ば,消化により30種類のペプチドを生じるが共溶出又は非回
92
ション試験において,混合物試料を試験しペプチドマップで共
39
収により20個のピークしか検出されないかもしれない.不十
93
溶出することにより二つのピークが同一であることを実証でき
40
分な分離を同定し,適切なクロマトグラフィー手順により解決
94
れば,同一性を確認することができる.化学的に修飾された標
41
する必要がある.必要に応じて,ペプチド標準品/標準物質の
95
準品/標準物質は,pHや温度の条件や一次構造に変化を起こ
42
使用や,若しくはシステム性能の基準により管理する.
96
すことが知られる化学試薬への曝露により作成できる.これら
43
8.10.
97
の変化として,アスパラギン及びグルタミン残基の脱アミド化,
システム適合性の基準の選択
44
システム適合性の基準は,試料タンパク質の消化,分離及び
98
メチオニン,ヒスチジン又はトリプトファン残基の酸化,並び
45
検出の手順が,分析目的に応じて求められるレベルの構造同定
99
に酸触媒によるペプチド結合の切断などが挙げられる.化学的
46
が可能な能力を有することを確認できるように設定すべきであ
100
に修飾された標準品/標準物質及び標準品/標準物質のペプチ
47
る.確認試験として日常的な分析で評価されるシステム適合性
101
ドマップをあらかじめ決めておいた判定基準に基づいて比較す
48
の基準については,一般的に参照タンパク質消化物のクロマト
102
ることにより,アミノ酸の側鎖の修飾がペプチドマップ法の特
49
グラムの評価が実施されることに加え,次のような性能特性が
103
異性に影響を及ぼすか否かを示すことができる.
50
評価されることもある.
104
9.2.
51
(1)参照クロマトグラムとの定性的な類似性
105
ペプチドマップ法の手順の精度(併行精度,室内再現精度)の
52
(2)消化の程度
106
測定を容易にするために,経験的に用いられているピークレス
53
(3)部分的な切断
107
ポンス(ピーク面積又はピーク高さ)及びピーク保持係数の数値
54
(4)非特異的な切断
108
化の方法を手順に含むべきである.一つのアプローチとしては,
精度
1
マップ法を用いて同定されたアミノ酸配列の割合を指す.全て
55
(5)ピーク高さ/シグナルノイズ比
2
の分析目的に対応する特定の数値は存在しないが,多くの場合
56
(6)ピーク形状
3
95%程度の配列カバー率がペプチドマップ法において許容で
57
(7)ピークの保持時間
4
きる性能の目標である.
58
(8)特定のピークの分解能
5
8.2.
59
試料の分離,精製又は濃縮を必要とする試験方法の手順に対
6
特異的な結合切断
60
しては,試料の回収率の基準を設定すべきであり,システム適
7
合は,同定し,記録する.
61
合性の評価の一部として設定するべきである.消化により生じ
8
8.3.
62
たアーティファクトが認められる場合には,妨害のないことを
63
実証するためにブランク消化試料を評価することが必要となる.
9.
9
選択した酵素又は化学的消化手順により切断される特異的結
主なピーク
特異的な結合の切断により回収された主なペプチドは,同定
10
し,記録する.
64
11
8.4.
バリデーション
65
ペプチドマップ法の手順のバリデーションを実施する前に,
12
部分的又は不完全な切断を生じやすいペプチド結合及び関連
66
試験操作手順は最終化しシステム適合性の基準と一緒に文書化
13
するクロマトグラム上のピークやシグナルは同定する必要があ
67
すべきである.試験を行うたびに,結果をシステム適合性の基
14
る.
68
準で評価し,過去の試験結果と一致する再現性のある結果が得
15
8.5.
69
られているかを判断する.最終化する前は,判定基準がシステ
70
ム適合性の基準によってしばしば変化することがある.分析バ
16
部分的切断
マイナー/非特異的切断
非特異的な結合の切断の程度は同定し,制限又は管理する必
17
要がある.
71
リデーションにおけるプロトコールの要素は次のとおりである.
18
8.6.
72
9.1.
プロテアーゼ由来のピーク
特異性
19
プロテアーゼが試料タンパク質の消化に用いられる場合は,
73
分析性能の要件は,確認試験の目的により異なり,リスクア
20
バックグラウンドに認められるプロテアーゼ由来のピークを同
74
セスメントを行うことにより同一施設で製造されるタンパク質
21
定し,必要に応じて制限する必要がある.
75
医薬品と試料タンパク質を区別するためにどの程度の特異性が
22
8.7.
76
必要かを理解する必要がある.ペプチドマップ法は,試料の一
23
未消化の「コア」タンパク質
77
次構造が参照タンパク質と一致することを確認する相対比較の
24
ア」と呼ばれる)は同定し,制限する必要がある.
78
手法である.特異性は適切な標準品/標準物質と構造の類似し
25
8.8.
79
たタンパク質試料のペプチドマップと比較することにより確認
未消化又は部分的に消化されたタンパク質(しばしば「コ
平均ペプチド長
26
選択したプロテアーゼ又は化学的切断試薬と試料タンパク質
80
される.比較試料は,同一施設で製造される他のタンパク質医
27
の組み合わせにより生成する一連のペプチドを記述する.小さ
81
薬品に関するリスクアセスメントに基づき選択し,バリデーシ
28
なペプチドと大きなペプチドはトレードオフの関係にある.小
82
ョンのプロトコールとして文書化するべきである.試験の本質
29
さなペプチドは,ペプチドマップ法において高い構造選択性を
83
的なばらつきを最小化するために,試験時には標準品/標準物
30
示すが,多くのピークを示す複雑なマップとなる.一方で,長
84
質及び試料タンパク質に対して試験操作を実施する.特異性の
31
いペプチドは構造変異体を分離する能力は低くなるが単純なマ
85
バリデーション試験として試料タンパク質消化物,標準品/標
32
ップが得られる.全ての分析目的に適切な特定のペプチド長は
86
準物質の消化物及び検体並びに標準品/標準物質の消化物の
33
存在しないが,一般的には平均ペプチド長は10 ~ 20残基が適
87
1:1(v/v)混合液を分析することはペプチドマップ法の試験デ
34
切と考えられる.
88
ザインとして有用といえる.試料タンパク質のペプチドマップ
35
8.9.
89
における試料タンパク質のピークと,標準品/標準物質の対応
分解能
36
分解能は,プロテアーゼ又は化学的切断試薬により生成した
90
するピークの保持時間が僅かに異なることにより,分析者がピ
37
一連のペプチドを分離するシステムの能力のことをいう.例え
91
ークは同一ではないと判断することがある.特異性のバリデー
38
ば,消化により30種類のペプチドを生じるが共溶出又は非回
92
ション試験において,混合物試料を試験しペプチドマップで共
39
収により20個のピークしか検出されないかもしれない.不十
93
溶出することにより二つのピークが同一であることを実証でき
40
分な分離を同定し,適切なクロマトグラフィー手順により解決
94
れば,同一性を確認することができる.化学的に修飾された標
41
する必要がある.必要に応じて,ペプチド標準品/標準物質の
95
準品/標準物質は,pHや温度の条件や一次構造に変化を起こ
42
使用や,若しくはシステム性能の基準により管理する.
96
すことが知られる化学試薬への曝露により作成できる.これら
43
8.10.
97
の変化として,アスパラギン及びグルタミン残基の脱アミド化,
システム適合性の基準の選択
44
システム適合性の基準は,試料タンパク質の消化,分離及び
98
メチオニン,ヒスチジン又はトリプトファン残基の酸化,並び
45
検出の手順が,分析目的に応じて求められるレベルの構造同定
99
に酸触媒によるペプチド結合の切断などが挙げられる.化学的
46
が可能な能力を有することを確認できるように設定すべきであ
100
に修飾された標準品/標準物質及び標準品/標準物質のペプチ
47
る.確認試験として日常的な分析で評価されるシステム適合性
101
ドマップをあらかじめ決めておいた判定基準に基づいて比較す
48
の基準については,一般的に参照タンパク質消化物のクロマト
102
ることにより,アミノ酸の側鎖の修飾がペプチドマップ法の特
49
グラムの評価が実施されることに加え,次のような性能特性が
103
異性に影響を及ぼすか否かを示すことができる.
50
評価されることもある.
104
9.2.
51
(1)参照クロマトグラムとの定性的な類似性
105
ペプチドマップ法の手順の精度(併行精度,室内再現精度)の
52
(2)消化の程度
106
測定を容易にするために,経験的に用いられているピークレス
53
(3)部分的な切断
107
ポンス(ピーク面積又はピーク高さ)及びピーク保持係数の数値
54
(4)非特異的な切断
108
化の方法を手順に含むべきである.一つのアプローチとしては,
精度