よむ、つかう、まなぶ。
「再生医療等製品及び生物由来製品に関する感染症定期報告制度について」の一部改正について (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00010.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和3年度第2回 3/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
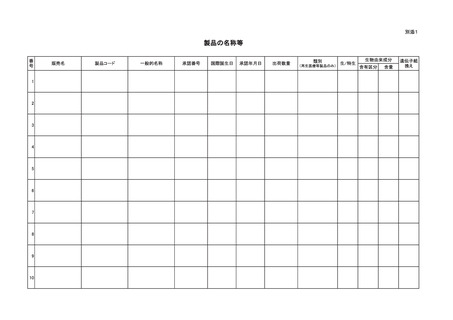
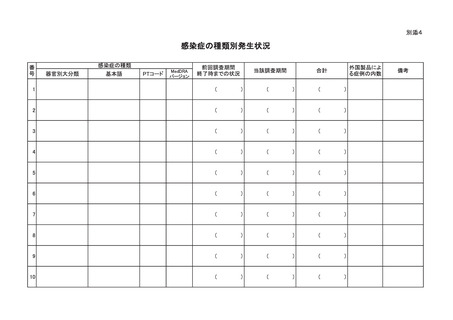
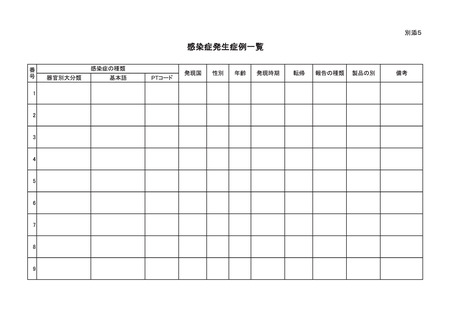
別紙様式
感染症定期報告書
区分1
区分2
製品の販売名
名
生物由来成分の
名称等
称
原材料名
原産国
調 査 期 間
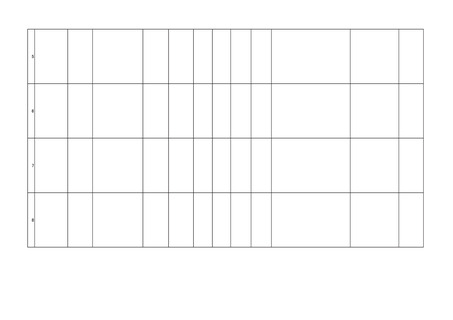
同一生物種等から人に感染すると認められ
る疾病についての研究報告
当該製品等によるものと
疑われる感染症
~
報告の有無
感染症の有無
適正使用等確保措
置の有無
適正使用等確保措置
安全性に関する見解等
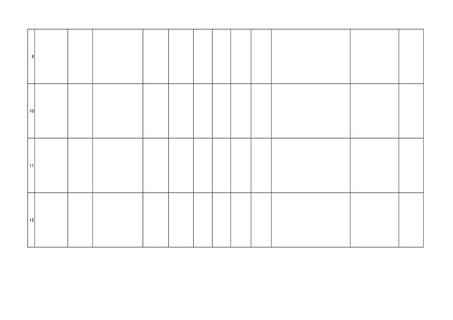
適正
使用
情報
外国における措置
外国における措置
の有無
その他の適正使用情報
適正使用情報の
有無
送信者識別子
備
考
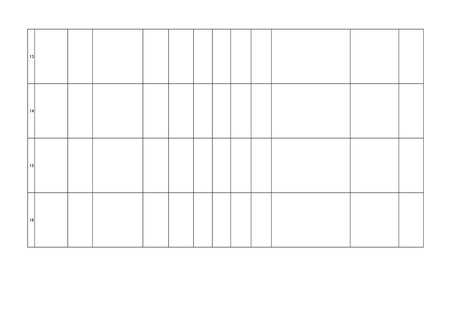
上記により感染症定期報告を行います。
令和
年
月
日
住所
企業名
氏名
独立行政法人医薬品医療機器総合機構理事長 殿
起 算 日
感染症定期報告書
区分1
区分2
製品の販売名
名
生物由来成分の
名称等
称
原材料名
原産国
調 査 期 間
同一生物種等から人に感染すると認められ
る疾病についての研究報告
当該製品等によるものと
疑われる感染症
~
報告の有無
感染症の有無
適正使用等確保措
置の有無
適正使用等確保措置
安全性に関する見解等
適正
使用
情報
外国における措置
外国における措置
の有無
その他の適正使用情報
適正使用情報の
有無
送信者識別子
備
考
上記により感染症定期報告を行います。
令和
年
月
日
住所
企業名
氏名
独立行政法人医薬品医療機器総合機構理事長 殿
起 算 日