よむ、つかう、まなぶ。
「再生医療等製品及び生物由来製品に関する感染症定期報告制度について」の一部改正について (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00010.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和3年度第2回 3/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
おり定めたので、貴管下関係業者等に対し、周知徹底を図るとともに、指導方
御配慮をお願いいたします。
本通知は平成 29 年 11 月1日から施行します。
なお、本通知の施行に伴い、旧再生医療等製品局長通知及び旧生物由来製品
局長通知は廃止します。
記
1 報告を求める事項について
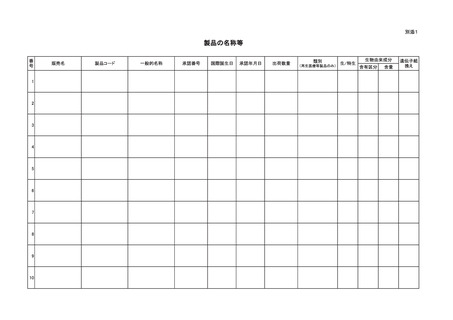
(1)当該再生医療等製品又は当該生物由来製品の名称
(2)承認番号及び承認年月日
(3)調査期間
(4)当該再生医療等製品又は当該生物由来製品の出荷数量
(5)当該再生医療等製品又は当該生物由来製品の原材料若しくは原料若し
くは材料に係る人その他の生物(植物を除く。以下同じ。)と同じ人その
他の生物、当該再生医療等製品又は当該生物由来製品について報告され
た、人その他の生物から人に感染すると認められる疾病についての研究
報告
(6)当該再生医療等製品、当該生物由来製品又は外国で使用されている物
であって、これらの成分(当該再生医療等製品若しくは当該生物由来製
品に含有され、又は製造工程において使用されている人その他の生物に
由来するものに限る。)と同一性を有すると認められる人その他の生物に
由来する成分を含有し、若しくは製造工程において使用している製品(以
下それぞれ、
「当該再生医療等製品等」又は「当該生物由来製品等」とい
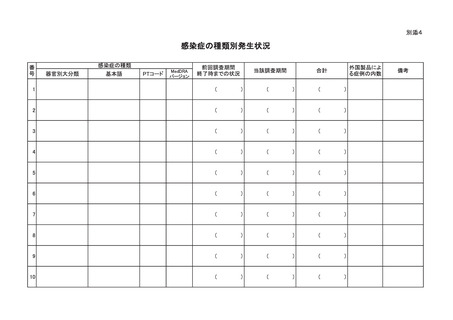
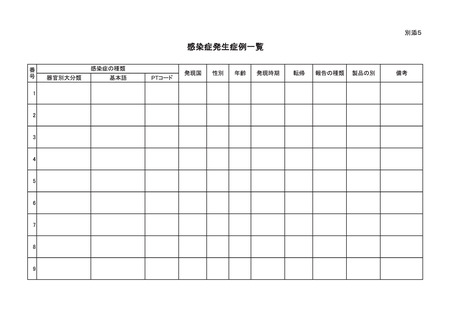
う。)によるものと疑われる感染症の種類別発生状況及び発生症例一覧
(7)当該再生医療等製品等又は当該生物由来製品等による保健衛生上の危
害の発生若しくは拡大の防止又は当該再生医療等製品又は当該生物由来
製品の適正な使用のために行われた措置
(8)当該再生医療等製品又は当該生物由来製品の安全性に関する当該報告
を行う者の見解
(9)当該再生医療等製品又は当該生物由来製品の注意事項等情報
(10)当該再生医療等製品等又は当該生物由来製品等の品質、有効性及び安
全性に関する事項その他当該再生医療等製品又は当該生物由来製品の適
正な使用のために必要な情報
2
調査対象期間及び報告時期について
当該報告は、報告起算日から6月(厚生労働大臣が指定する再生医療等製
品又は生物由来製品にあっては、厚生労働大臣が指定する期間。以下「調査
御配慮をお願いいたします。
本通知は平成 29 年 11 月1日から施行します。
なお、本通知の施行に伴い、旧再生医療等製品局長通知及び旧生物由来製品
局長通知は廃止します。
記
1 報告を求める事項について
(1)当該再生医療等製品又は当該生物由来製品の名称
(2)承認番号及び承認年月日
(3)調査期間
(4)当該再生医療等製品又は当該生物由来製品の出荷数量
(5)当該再生医療等製品又は当該生物由来製品の原材料若しくは原料若し
くは材料に係る人その他の生物(植物を除く。以下同じ。)と同じ人その
他の生物、当該再生医療等製品又は当該生物由来製品について報告され
た、人その他の生物から人に感染すると認められる疾病についての研究
報告
(6)当該再生医療等製品、当該生物由来製品又は外国で使用されている物
であって、これらの成分(当該再生医療等製品若しくは当該生物由来製
品に含有され、又は製造工程において使用されている人その他の生物に
由来するものに限る。)と同一性を有すると認められる人その他の生物に
由来する成分を含有し、若しくは製造工程において使用している製品(以
下それぞれ、
「当該再生医療等製品等」又は「当該生物由来製品等」とい
う。)によるものと疑われる感染症の種類別発生状況及び発生症例一覧
(7)当該再生医療等製品等又は当該生物由来製品等による保健衛生上の危
害の発生若しくは拡大の防止又は当該再生医療等製品又は当該生物由来
製品の適正な使用のために行われた措置
(8)当該再生医療等製品又は当該生物由来製品の安全性に関する当該報告
を行う者の見解
(9)当該再生医療等製品又は当該生物由来製品の注意事項等情報
(10)当該再生医療等製品等又は当該生物由来製品等の品質、有効性及び安
全性に関する事項その他当該再生医療等製品又は当該生物由来製品の適
正な使用のために必要な情報
2
調査対象期間及び報告時期について
当該報告は、報告起算日から6月(厚生労働大臣が指定する再生医療等製
品又は生物由来製品にあっては、厚生労働大臣が指定する期間。以下「調査