よむ、つかう、まなぶ。
「再生医療等製品及び生物由来製品に関する感染症定期報告制度について」の一部改正について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00010.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和3年度第2回 3/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(参考)改正後の局長通知
下線部は、改正後の局長通知における「「再生医療等製品及び生物由来製品
に関する感染症定期報告制度について」の一部改正について」(令和3年7月
30日付け薬生発0730第5号)による改正箇所である。
薬 生 発 0428第 1 号
平 成 29年 4 月 28日
各都道府県知事
殿
厚生労働省医薬・生活衛生局長
(公 印 省 略)
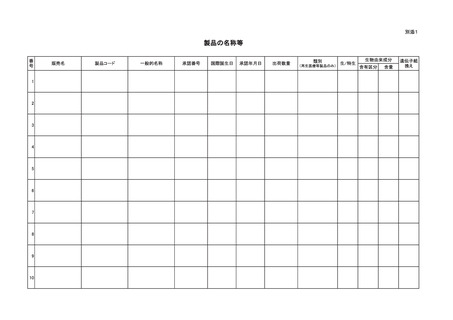
再生医療等製品及び生物由来製品に関する感染症定期報告制度について
再生医療等製品及び生物由来製品の感染症対策については、「医薬品、医療
機器等の品質、有効性及び安全性の確保等に関する法律」(昭和 35 年法律第
145 号。)第 68 条の 14 及び同第 68 条の 24 において、再生医療等製品、生物由
来製品又はその原料若しくは材料による感染症に関する最新の論文その他によ
り得られた知見に基づき、当該再生医療等製品又は当該生物由来製品を評価し、
その成果を厚生労働大臣に定期的に報告しなければならないこととされていま
す。また、その報告事項等については、
「医薬品、医療機器等の品質、有効性及
び安全性の確保等に関する法律施行規則」
(昭和 36 年厚生省令第1号。)第 228
条の 25 及び同第 241 条で定められており、報告方法等については、再生医療等
製品は、
「再生医療等製品に関する感染症定期報告制度について」
(平成 26 年8
月 12 日付け薬食発第 0812 第7号厚生労働省医薬食品局長通知。以下「旧再生
医療等製品局長通知」という。)により、生物由来製品は、「生物由来製品に関
する感染症定期報告制度について」
(平成 15 年5月 15 日付け医薬発第 0515008
号厚生労働省医薬局長通知。以下「旧生物由来製品局長通知」という。)により
それぞれ示されているところです。
今般、情報管理の効率化のため、報告書の様式を改めるとともに電子媒体に
よる提出を求めることから、感染症定期報告制度に関する報告方法を下記のと
下線部は、改正後の局長通知における「「再生医療等製品及び生物由来製品
に関する感染症定期報告制度について」の一部改正について」(令和3年7月
30日付け薬生発0730第5号)による改正箇所である。
薬 生 発 0428第 1 号
平 成 29年 4 月 28日
各都道府県知事
殿
厚生労働省医薬・生活衛生局長
(公 印 省 略)
再生医療等製品及び生物由来製品に関する感染症定期報告制度について
再生医療等製品及び生物由来製品の感染症対策については、「医薬品、医療
機器等の品質、有効性及び安全性の確保等に関する法律」(昭和 35 年法律第
145 号。)第 68 条の 14 及び同第 68 条の 24 において、再生医療等製品、生物由
来製品又はその原料若しくは材料による感染症に関する最新の論文その他によ
り得られた知見に基づき、当該再生医療等製品又は当該生物由来製品を評価し、
その成果を厚生労働大臣に定期的に報告しなければならないこととされていま
す。また、その報告事項等については、
「医薬品、医療機器等の品質、有効性及
び安全性の確保等に関する法律施行規則」
(昭和 36 年厚生省令第1号。)第 228
条の 25 及び同第 241 条で定められており、報告方法等については、再生医療等
製品は、
「再生医療等製品に関する感染症定期報告制度について」
(平成 26 年8
月 12 日付け薬食発第 0812 第7号厚生労働省医薬食品局長通知。以下「旧再生
医療等製品局長通知」という。)により、生物由来製品は、「生物由来製品に関
する感染症定期報告制度について」
(平成 15 年5月 15 日付け医薬発第 0515008
号厚生労働省医薬局長通知。以下「旧生物由来製品局長通知」という。)により
それぞれ示されているところです。
今般、情報管理の効率化のため、報告書の様式を改めるとともに電子媒体に
よる提出を求めることから、感染症定期報告制度に関する報告方法を下記のと