よむ、つかう、まなぶ。
「再生医療等製品及び生物由来製品に関する感染症定期報告制度について」の一部改正について (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190382_00010.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・再生医療等製品安全対策部会(令和3年度第2回 3/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
5 報告上の留意点について
(1)一括報告
同一承認取得者が承認を受けた再生医療等製品又は生物由来製品につい
ては、当該再生医療等製品又は当該生物由来製品に含有し、又は製造工程
において使用している原料又は材料(人その他の生物に由来するものに限
る。以下「生物由来成分」という。)ごとにとりまとめて、一括して報告
することができる。
この場合、一括して報告するもののうち次回調査単位満了日の最も早い
日までの一括した調査を行い、その後、当該調査単位満了日から、一括し
て報告するもののうち最も短い調査単位期間ごとに調査し、上記2に従い
期間内に報告すること。
(2)一の再生医療等製品又は生物由来製品に複数の生物由来成分を含有す
る場合等の報告
一の再生医療等製品又は生物由来製品について、複数の生物由来成分を
含有し、又は製造工程において使用している場合、それぞれの生物由来成
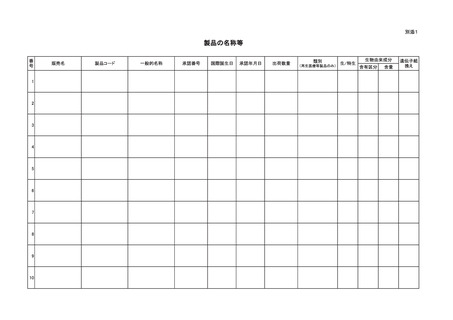
分ごとに、別紙様式を作成し、報告すること。
なお、この場合においても、当該生物由来成分ごとに、上記5(1)に
従い、一括して報告して差し支えない。
(1)一括報告
同一承認取得者が承認を受けた再生医療等製品又は生物由来製品につい
ては、当該再生医療等製品又は当該生物由来製品に含有し、又は製造工程
において使用している原料又は材料(人その他の生物に由来するものに限
る。以下「生物由来成分」という。)ごとにとりまとめて、一括して報告
することができる。
この場合、一括して報告するもののうち次回調査単位満了日の最も早い
日までの一括した調査を行い、その後、当該調査単位満了日から、一括し
て報告するもののうち最も短い調査単位期間ごとに調査し、上記2に従い
期間内に報告すること。
(2)一の再生医療等製品又は生物由来製品に複数の生物由来成分を含有す
る場合等の報告
一の再生医療等製品又は生物由来製品について、複数の生物由来成分を
含有し、又は製造工程において使用している場合、それぞれの生物由来成
分ごとに、別紙様式を作成し、報告すること。
なお、この場合においても、当該生物由来成分ごとに、上記5(1)に
従い、一括して報告して差し支えない。