よむ、つかう、まなぶ。
資料1-2 MID-NET・NDBの行政利活用の調査実施状況について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24331.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和3年度 第3回 3/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別添資料1
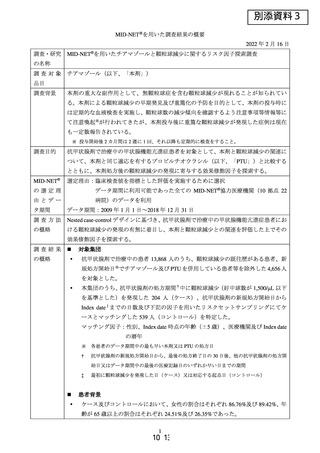
MID-NET®を用いた調査結果の概要
2022 年 2 月 1 日
調査・研究
の名称
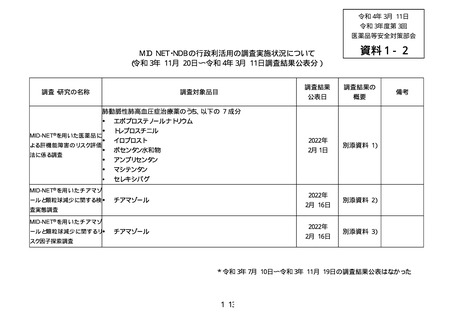
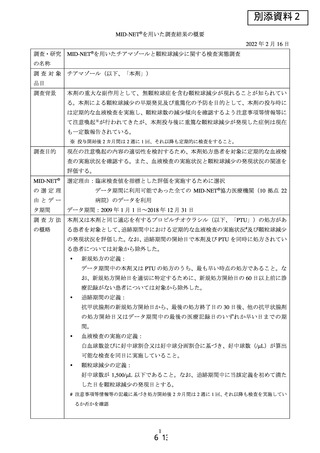
MID-NET®を用いた医薬品による肝機能障害のリスク評価法に係る調査
調査対象
肺動脈性肺高血圧症治療薬(以下、「PAH 治療薬」)のうち、以下の 7 成分
品目
エポプロステノールナトリウム、トレプロスチニル、イロプロスト、ボセンタン水和物、
アンブリセンタン、マシテンタン、セレキシパグ
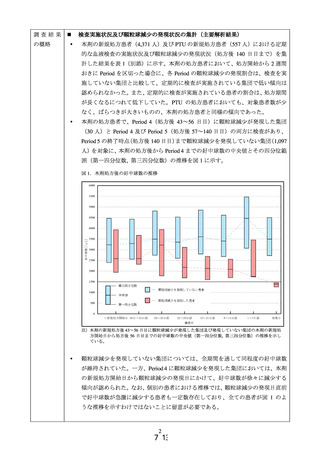
調査背景
肝機能障害は医薬品の投与によって発現が認められることの多い事象であり、MIDNET®で評価可能な肝機能障害の特徴を把握しておくことは、MID-NET®の今後の応
用を考える上で重要である。
PAH 治療薬は、本邦においていずれも全例調査が実施されており、投与後の肝機能
障害の発現状況に係る情報が得られている。
調査目的
本邦において製造販売されている PAH 治療薬について、品目横断的に肝機能障害との
関連を検討し、全例調査の結果と比較しつつ、MID-NET®における最適な評価手法を検
討する。
MID-NET®
選定理由:MID-NET®を用いた肝機能障害のリスク評価法を検討するために選択
の選定理
データ期間に利用可能であった全ての MID-NET®協力医療機関(10 拠点 22
由とデー
病院)のデータを利用
タ期間
調査方法
の概略
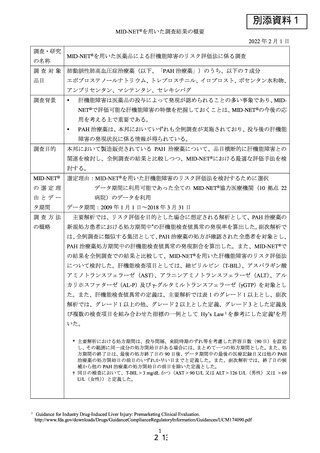
データ期間:2009 年 1 月 1 日~2018 年 3 月 31 日
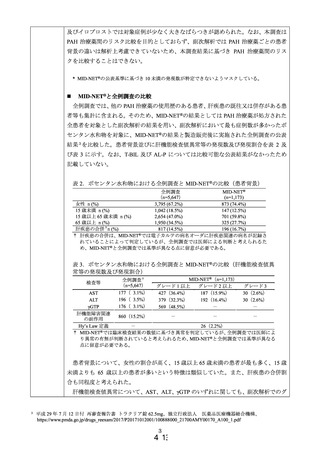
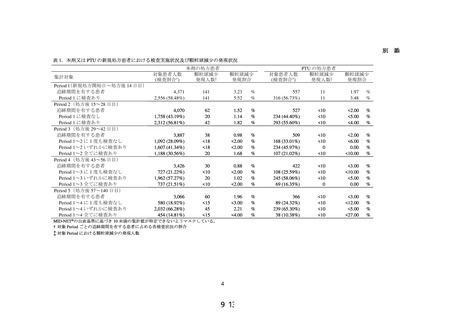
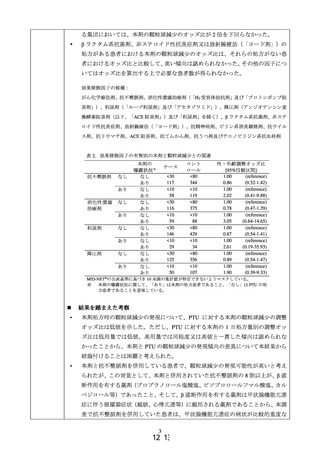
主要解析では、リスク評価を目的とした場合に想定される解析として、PAH 治療薬の
新規処方患者における処方期間中*の肝機能検査値異常の発現率を算出した。副次解析で
は、全例調査に類似する集団として、PAH 治療薬の処方が確認された全患者を対象とし、
PAH 治療薬処方期間中の肝機能検査値異常の発現割合を算出した。また、MID-NET®で
の結果を全例調査での結果と比較して、MID-NET®を用いた肝機能障害のリスク評価法
について検討した。肝機能検査項目としては、総ビリルビン(T-BIL)、アスパラギン酸
アミノトランスフェラーゼ(AST)、アラニンアミノトランスフェラーゼ(ALT)、アル
カリホスファターゼ(AL-P)及び γ-グルタミルトランスフェラーゼ(γGTP)を対象とし
た。また、肝機能検査値異常の定義は、主要解析では表 1 のグレード 1 以上とし、副次
解析では、グレード 1 以上の他、グレード 2 以上とした定義、グレード 3 とした定義及
び複数の検査項目を組み合わせた指標の一例として Hy’s Law1を参考にした定義†を用
いた。
* 主要解析における処方期間は、投与間隔、来院時期のずれ等を考慮した許容日数(90 日)を設定
し、その範囲に同一成分の処方開始日がある場合には、まとめて一つの処方期間とした。また、処
方期間の終了日は、最後の処方終了日の 90 日後、データ期間中の最後の医療記録日又は他の PAH
治療薬の処方開始日の前日のいずれか早い日までと定義した。また、副次解析では、終了日の候
補から他の PAH 治療薬の処方開始日の前日を除いた定義とした。
† 同日の検査において、T-BIL > 3 mg/dL かつ(AST > 90 U/L 又は ALT > 126 U/L(男性)又は > 69
U/L(女性)
)と定義した。
1
Guidance for Industry Drug-Induced Liver Injury: Premarketing Clinical Evaluation.
http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM174090.pdf
1
2/13
MID-NET®を用いた調査結果の概要
2022 年 2 月 1 日
調査・研究
の名称
MID-NET®を用いた医薬品による肝機能障害のリスク評価法に係る調査
調査対象
肺動脈性肺高血圧症治療薬(以下、「PAH 治療薬」)のうち、以下の 7 成分
品目
エポプロステノールナトリウム、トレプロスチニル、イロプロスト、ボセンタン水和物、
アンブリセンタン、マシテンタン、セレキシパグ
調査背景
肝機能障害は医薬品の投与によって発現が認められることの多い事象であり、MIDNET®で評価可能な肝機能障害の特徴を把握しておくことは、MID-NET®の今後の応
用を考える上で重要である。
PAH 治療薬は、本邦においていずれも全例調査が実施されており、投与後の肝機能
障害の発現状況に係る情報が得られている。
調査目的
本邦において製造販売されている PAH 治療薬について、品目横断的に肝機能障害との
関連を検討し、全例調査の結果と比較しつつ、MID-NET®における最適な評価手法を検
討する。
MID-NET®
選定理由:MID-NET®を用いた肝機能障害のリスク評価法を検討するために選択
の選定理
データ期間に利用可能であった全ての MID-NET®協力医療機関(10 拠点 22
由とデー
病院)のデータを利用
タ期間
調査方法
の概略
データ期間:2009 年 1 月 1 日~2018 年 3 月 31 日
主要解析では、リスク評価を目的とした場合に想定される解析として、PAH 治療薬の
新規処方患者における処方期間中*の肝機能検査値異常の発現率を算出した。副次解析で
は、全例調査に類似する集団として、PAH 治療薬の処方が確認された全患者を対象とし、
PAH 治療薬処方期間中の肝機能検査値異常の発現割合を算出した。また、MID-NET®で
の結果を全例調査での結果と比較して、MID-NET®を用いた肝機能障害のリスク評価法
について検討した。肝機能検査項目としては、総ビリルビン(T-BIL)、アスパラギン酸
アミノトランスフェラーゼ(AST)、アラニンアミノトランスフェラーゼ(ALT)、アル
カリホスファターゼ(AL-P)及び γ-グルタミルトランスフェラーゼ(γGTP)を対象とし
た。また、肝機能検査値異常の定義は、主要解析では表 1 のグレード 1 以上とし、副次
解析では、グレード 1 以上の他、グレード 2 以上とした定義、グレード 3 とした定義及
び複数の検査項目を組み合わせた指標の一例として Hy’s Law1を参考にした定義†を用
いた。
* 主要解析における処方期間は、投与間隔、来院時期のずれ等を考慮した許容日数(90 日)を設定
し、その範囲に同一成分の処方開始日がある場合には、まとめて一つの処方期間とした。また、処
方期間の終了日は、最後の処方終了日の 90 日後、データ期間中の最後の医療記録日又は他の PAH
治療薬の処方開始日の前日のいずれか早い日までと定義した。また、副次解析では、終了日の候
補から他の PAH 治療薬の処方開始日の前日を除いた定義とした。
† 同日の検査において、T-BIL > 3 mg/dL かつ(AST > 90 U/L 又は ALT > 126 U/L(男性)又は > 69
U/L(女性)
)と定義した。
1
Guidance for Industry Drug-Induced Liver Injury: Premarketing Clinical Evaluation.
http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM174090.pdf
1
2/13