よむ、つかう、まなぶ。
再生医療等の安全性の確保等に関する法律施行5年後の見直しに係る検討 (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24369.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第74回 3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
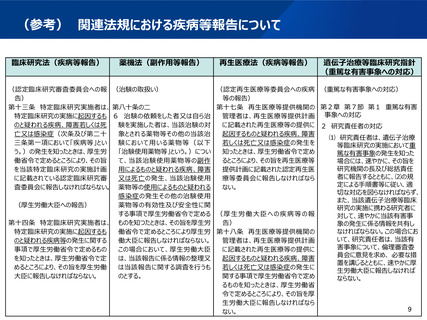
再生医療等安全性確保法における疾病等報告について
現状と課題
○ 再生医療等安全性確保法において、再生医療等提供機関の管理者は、再生医療等提供計画に記載された再生医療等の
提供に起因するものと疑われる疾病、障害若しくは死亡又は感染症の発生を知ったときは、再生医療等提供計画に記載された
認定再生医療等委員会(法第17条)及び厚生労働大臣(法第18条)に報告しなければならない。
○ 遺伝子治療等臨床研究に関する指針において、研究責任者は、遺伝子治療等臨床研究の実施において重篤な有害事象
(※)の発生を知った場合には、速やかに、その旨を研究機関の長及び総括責任者に報告するとともに、倫理審査委員会に意
見を求め、 必要な措置を講じるとともに、速やかに厚生労働大臣に報告しなければならない(指針第2章第7節第1の2)。
(※)この指針において「有害事象」とは、実施された遺伝子治療等臨床研究との因果関係の有無を問わず、被験者に生じた
全ての好ましくない若しくは意図しない傷病又はその徴候(臨床検査値の異常を含む。)をいう。
○ 現状、遺伝子治療の提供後に発生した事象について、再生医療等安全性確保法と遺伝子治療等臨床研究に関する指針
において、報告する事項が異なる。
○ その他の法規では、例えば臨床研究法においては、再生医療等安全性確保法と同様に「特定臨床研究の実施に起因するも
のと疑われる疾病、障害若しくは死亡又は感染症」について報告を求めている。
検討の方向性
○ 遺伝子治療を再生医療等安全確保法の枠組みに含めるにあたり、遺伝子治療の提供後に発生した事象の報告は、現行法
や他法との整合性等を踏まえ、再生法で規定される疾病等とすることでどうか。
8
現状と課題
○ 再生医療等安全性確保法において、再生医療等提供機関の管理者は、再生医療等提供計画に記載された再生医療等の
提供に起因するものと疑われる疾病、障害若しくは死亡又は感染症の発生を知ったときは、再生医療等提供計画に記載された
認定再生医療等委員会(法第17条)及び厚生労働大臣(法第18条)に報告しなければならない。
○ 遺伝子治療等臨床研究に関する指針において、研究責任者は、遺伝子治療等臨床研究の実施において重篤な有害事象
(※)の発生を知った場合には、速やかに、その旨を研究機関の長及び総括責任者に報告するとともに、倫理審査委員会に意
見を求め、 必要な措置を講じるとともに、速やかに厚生労働大臣に報告しなければならない(指針第2章第7節第1の2)。
(※)この指針において「有害事象」とは、実施された遺伝子治療等臨床研究との因果関係の有無を問わず、被験者に生じた
全ての好ましくない若しくは意図しない傷病又はその徴候(臨床検査値の異常を含む。)をいう。
○ 現状、遺伝子治療の提供後に発生した事象について、再生医療等安全性確保法と遺伝子治療等臨床研究に関する指針
において、報告する事項が異なる。
○ その他の法規では、例えば臨床研究法においては、再生医療等安全性確保法と同様に「特定臨床研究の実施に起因するも
のと疑われる疾病、障害若しくは死亡又は感染症」について報告を求めている。
検討の方向性
○ 遺伝子治療を再生医療等安全確保法の枠組みに含めるにあたり、遺伝子治療の提供後に発生した事象の報告は、現行法
や他法との整合性等を踏まえ、再生法で規定される疾病等とすることでどうか。
8