よむ、つかう、まなぶ。
再生医療等の安全性の確保等に関する法律施行5年後の見直しに係る検討 (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24369.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第74回 3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
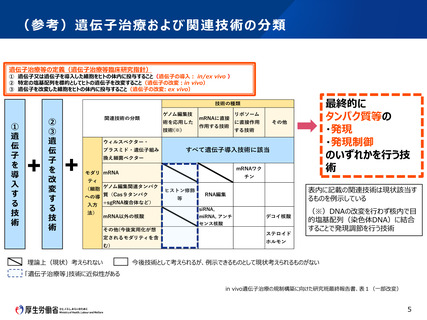
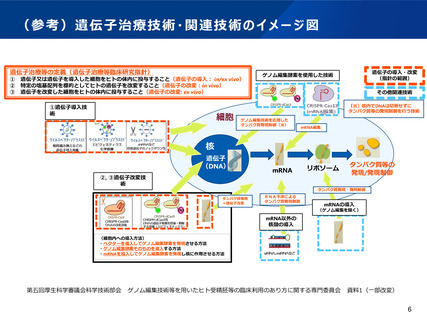
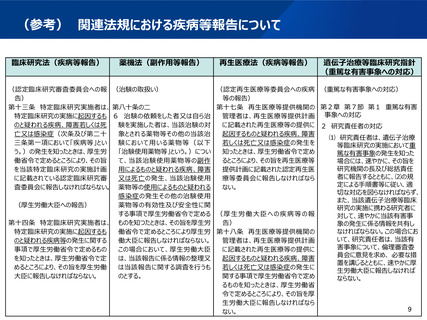
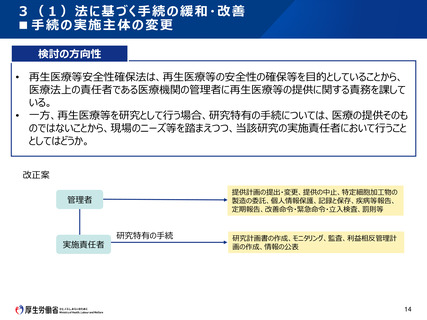
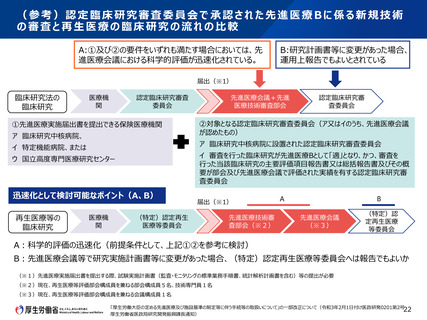
(参考)先進医療B試験に係る審査項目の比較
先進医療会議
先進医療技術審査
部会
認定再生医療等
委員会
認定臨床研究審査
委員会
有効性
○
○
○(※2)
○(※2)
安全性
○
○
○(※2)
○(※2)
実施体制
-
○
○
○
○(※1)
○
○
○
試験実施計画
-
○
○(※3)
○(※3)
実施医療機関の適格性
-
○
△(※4)
○(※5)
将来的な保険導入を目指す観点からの評価
○
○
-
-
社会的妥当性・効率性・将来の保険収載の必
要性の観点からみた保険給付との併用の適否
○
-
-
-
審査項目
倫理的観点
※1.社会的妥当性(社会的倫理的問題等)の観点から評価を行う
※2.研究計画書の記載事項(再生医療等安全性確保法規則第8条の4、臨床研究法規則第14条)通知で詳細説明、記載内容は同一
※3.生物統計家による評価は必須ではない
※4.第一種再生医療等又は第二種再生医療等の提供を行う医療機関は、当該医療機関において再生医療等を受ける者に対し、救急医療を行うために必要な施設又
は設備を有していなければならない。ただし、他の医療機関と連携することにより、当該者に対し、救急医療を行うために必要な体制があらかじめ確保されている場合には、この
限りでない(再生医療等安全性確保法施行規則第6条)
※5.研究責任医師は、臨床研究の内容に応じ、実施医療機関が救急医療に必要な施設又は設備を有していることを確認しなければならない。ただし、他の医療機関と
連携することにより、臨床研究の対象者に対し、救急医療を行うために必要な体制があらかじめ確保されている場合には、この限りでない。(臨床研究法施行規則第16条)
第74回先進医療会議(令和元年6月6日)の資料先-2を元に作成
21
先進医療会議
先進医療技術審査
部会
認定再生医療等
委員会
認定臨床研究審査
委員会
有効性
○
○
○(※2)
○(※2)
安全性
○
○
○(※2)
○(※2)
実施体制
-
○
○
○
○(※1)
○
○
○
試験実施計画
-
○
○(※3)
○(※3)
実施医療機関の適格性
-
○
△(※4)
○(※5)
将来的な保険導入を目指す観点からの評価
○
○
-
-
社会的妥当性・効率性・将来の保険収載の必
要性の観点からみた保険給付との併用の適否
○
-
-
-
審査項目
倫理的観点
※1.社会的妥当性(社会的倫理的問題等)の観点から評価を行う
※2.研究計画書の記載事項(再生医療等安全性確保法規則第8条の4、臨床研究法規則第14条)通知で詳細説明、記載内容は同一
※3.生物統計家による評価は必須ではない
※4.第一種再生医療等又は第二種再生医療等の提供を行う医療機関は、当該医療機関において再生医療等を受ける者に対し、救急医療を行うために必要な施設又
は設備を有していなければならない。ただし、他の医療機関と連携することにより、当該者に対し、救急医療を行うために必要な体制があらかじめ確保されている場合には、この
限りでない(再生医療等安全性確保法施行規則第6条)
※5.研究責任医師は、臨床研究の内容に応じ、実施医療機関が救急医療に必要な施設又は設備を有していることを確認しなければならない。ただし、他の医療機関と
連携することにより、臨床研究の対象者に対し、救急医療を行うために必要な体制があらかじめ確保されている場合には、この限りでない。(臨床研究法施行規則第16条)
第74回先進医療会議(令和元年6月6日)の資料先-2を元に作成
21