よむ、つかう、まなぶ。
再生医療等の安全性の確保等に関する法律施行5年後の見直しに係る検討 (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24369.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第74回 3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
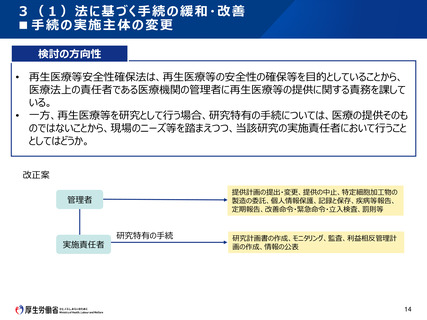
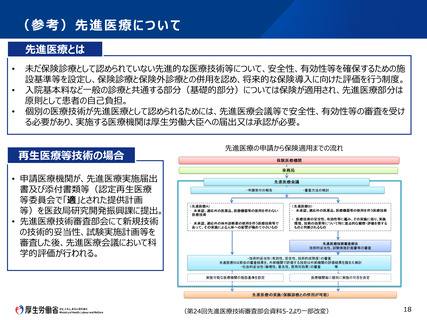
3(1)法に基づく手続の緩和・改善
・先進医療として行う場合の手続
■ 再生医療等安全性確保法施行5年後の見直しの検討に係る中間整理(令和元年12月25日)
現状と課題
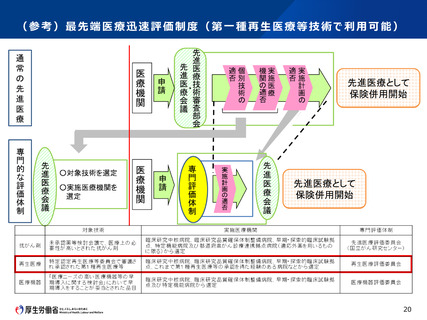
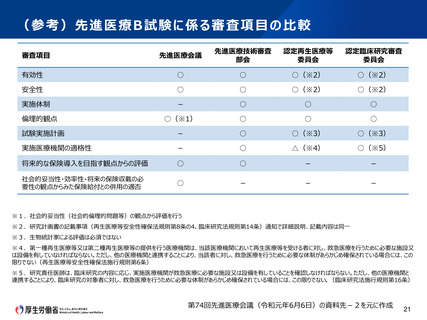
• 再生医療等安全性確保法の下で行う臨床研究について、先進医療として申請する場合、認定再生医
療等委員会(第一種の場合は、加えて再生医療等評価部会)に加え、先進医療技術審査部会及
び先進医療会議でも審議を行う必要がある。
これまでの主な議論
• 先進医療について、法に基づく審査と審査内容が重なる部分については、先進医療の手続の省略が可
能か否かについて、臨床研究法に基づく臨床研究の取扱いを参考にしつつ、先進医療会議等において
検討していただくのがよいのではないかとの意見があった。
今後の対応の方向性
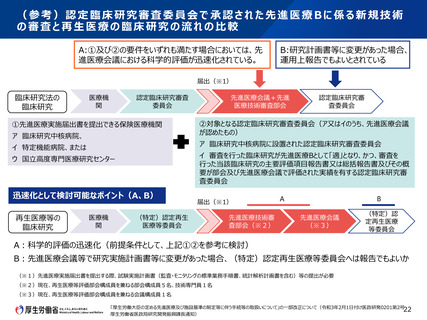
• 先進医療として臨床研究を実施する場合で、かつ、一定の要件を満たした認定再生医療等委員会の
審査を経た場合における、先進医療技術審査部会及び先進医療会議の審査過程の簡略化について、
臨床研究法に基づく臨床研究の取扱いも参考にしつつ、先進医療会議等において検討すべきである。
(※)J003-4 多血小板血漿処置
16
・先進医療として行う場合の手続
■ 再生医療等安全性確保法施行5年後の見直しの検討に係る中間整理(令和元年12月25日)
現状と課題
• 再生医療等安全性確保法の下で行う臨床研究について、先進医療として申請する場合、認定再生医
療等委員会(第一種の場合は、加えて再生医療等評価部会)に加え、先進医療技術審査部会及
び先進医療会議でも審議を行う必要がある。
これまでの主な議論
• 先進医療について、法に基づく審査と審査内容が重なる部分については、先進医療の手続の省略が可
能か否かについて、臨床研究法に基づく臨床研究の取扱いを参考にしつつ、先進医療会議等において
検討していただくのがよいのではないかとの意見があった。
今後の対応の方向性
• 先進医療として臨床研究を実施する場合で、かつ、一定の要件を満たした認定再生医療等委員会の
審査を経た場合における、先進医療技術審査部会及び先進医療会議の審査過程の簡略化について、
臨床研究法に基づく臨床研究の取扱いも参考にしつつ、先進医療会議等において検討すべきである。
(※)J003-4 多血小板血漿処置
16