よむ、つかう、まなぶ。
資料1:臨床研究で得られた情報を薬事申請に利活用できる仕組み (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
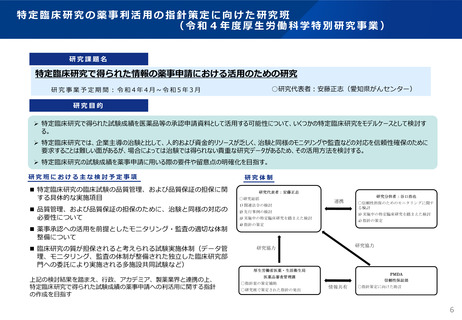
「特定臨床研究で得られた情報の薬事申請における活用のための研究」
の総括研究報告書及びこれを踏まえた取扱について
➢ 特定臨床研究で得られた試験成績を医薬品等の承認申請資料として活用する可能性について、いくつかの特定臨床研究を検討する。
➢ 特定臨床研究では、企業主導の治験と比して、人的および資金的リソースが乏しく、治験と同様のモニタリングや監査などの対応を信頼性確保のた
めに要求することは難しい面があるが、場合によっては治験では得られない貴重な研究データがあるため、その活用方法を検討する。
➢ 特定臨床研究の試験成績を薬事申請に用いる際の要件や留意点の明確化
利用できる可能性がある疾患
・「「特定臨床研究で得られた情報の薬事申請における活用のための研究」の総括研究報告書及びこれを踏まえた取扱について」
(令和5年3月31日薬生薬審発0331第1号厚生労働省医薬・生活衛生局医薬品審査管理課長通知)
・「適応外使用に係る医療用医薬品の取り扱いに関する質疑応答集(Q&A)について」 (令和5年3月31日付医薬品審査管理課事務連絡)
特定臨床研究として実施された先進医療Bの主な対象疾患:悪性腫瘍、神経疾患、内分泌疾患、自己免疫疾患、小児疾患及びそれらの疾患で希少なも
のが報告されており、加えて、治験としての実施が困難な疾患(小児疾患全般や救急医療等)
→ 「治験と同程度の信頼性が確保されている場合や改めて治験を実施することが困難な場合」に該当するものは限定的に利用ができる可能性
該当性の判断基準
全般
留意事項
✓ 得られた試験成績
✓ 治験としての実施・再現が困難であること
✓ 根拠資料の保存状況を踏まえ、個別に判断
✓ PMDAの治験相談を活用すること
特定臨床研究で得られた試験成績の薬事申請への利用の該当可能性
✓ 試験計画の妥当性
✓ 利用する特定臨床研究以外の研究結果(悪い結果が得られた研究を含む)の有無
等も踏まえた上で総合的判断される
さらに、
✓ 国際的に信頼できる学術雑誌に掲載された試験結果
✓ 公開の場で試験計画等が適切に検討され実施された臨床試験(先進医療B等)
信頼性
✓ 特定臨床研究で得られた試験成績を評価資料とし
て承認申請に利用する場合には、承認申請におけ
る当該臨床研究の位置付け等を総合的に考慮
令和5年3月31日付 医薬品審査管理課事務連絡
相談先
厚生労働省医薬・生活衛生局医薬品審査管理課宛に個別に相談すること
7
の総括研究報告書及びこれを踏まえた取扱について
➢ 特定臨床研究で得られた試験成績を医薬品等の承認申請資料として活用する可能性について、いくつかの特定臨床研究を検討する。
➢ 特定臨床研究では、企業主導の治験と比して、人的および資金的リソースが乏しく、治験と同様のモニタリングや監査などの対応を信頼性確保のた
めに要求することは難しい面があるが、場合によっては治験では得られない貴重な研究データがあるため、その活用方法を検討する。
➢ 特定臨床研究の試験成績を薬事申請に用いる際の要件や留意点の明確化
利用できる可能性がある疾患
・「「特定臨床研究で得られた情報の薬事申請における活用のための研究」の総括研究報告書及びこれを踏まえた取扱について」
(令和5年3月31日薬生薬審発0331第1号厚生労働省医薬・生活衛生局医薬品審査管理課長通知)
・「適応外使用に係る医療用医薬品の取り扱いに関する質疑応答集(Q&A)について」 (令和5年3月31日付医薬品審査管理課事務連絡)
特定臨床研究として実施された先進医療Bの主な対象疾患:悪性腫瘍、神経疾患、内分泌疾患、自己免疫疾患、小児疾患及びそれらの疾患で希少なも
のが報告されており、加えて、治験としての実施が困難な疾患(小児疾患全般や救急医療等)
→ 「治験と同程度の信頼性が確保されている場合や改めて治験を実施することが困難な場合」に該当するものは限定的に利用ができる可能性
該当性の判断基準
全般
留意事項
✓ 得られた試験成績
✓ 治験としての実施・再現が困難であること
✓ 根拠資料の保存状況を踏まえ、個別に判断
✓ PMDAの治験相談を活用すること
特定臨床研究で得られた試験成績の薬事申請への利用の該当可能性
✓ 試験計画の妥当性
✓ 利用する特定臨床研究以外の研究結果(悪い結果が得られた研究を含む)の有無
等も踏まえた上で総合的判断される
さらに、
✓ 国際的に信頼できる学術雑誌に掲載された試験結果
✓ 公開の場で試験計画等が適切に検討され実施された臨床試験(先進医療B等)
信頼性
✓ 特定臨床研究で得られた試験成績を評価資料とし
て承認申請に利用する場合には、承認申請におけ
る当該臨床研究の位置付け等を総合的に考慮
令和5年3月31日付 医薬品審査管理課事務連絡
相談先
厚生労働省医薬・生活衛生局医薬品審査管理課宛に個別に相談すること
7